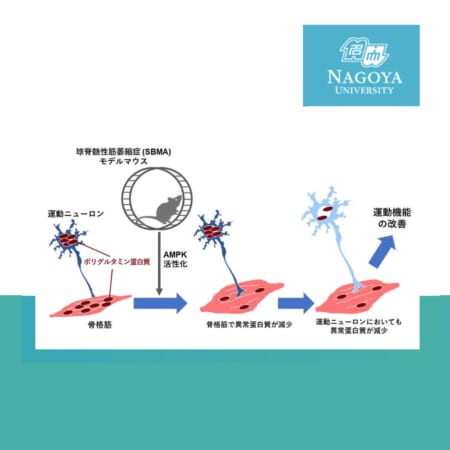
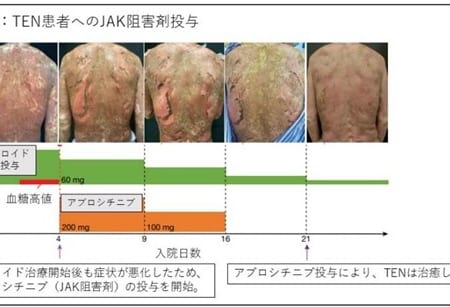
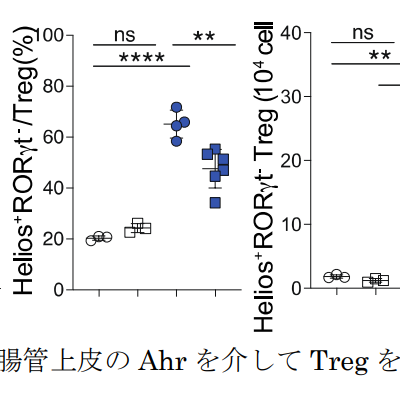
医療用HAL、HTLV-1関連脊髄症(HAM)および遺伝性痙性対麻痺の適応追加承認を取得
CYBERDYNE株式会社は10月27日、HAL医療用下肢タイプ(一般的名称:生体信号反応式運動機能改善装置、以下、医療用HAL)について、HTLV-1関連脊髄症および遺伝性痙性対麻痺の適応追加に係る製造販売承認事項一部変更が承認されたと発表しました。
HTLV-1関連脊髄症(HAM)は、脊髄が損傷することにより、歩行障害などの症状が現れる指定難病。遺伝性痙性対麻痺は、痙性対麻痺の症状が徐々に進行し、歩行障害などの症状が現れるごく稀に起こる遺伝性疾患です。
今回の承認は、新潟病院の中島孝医師が調整医師として実施した医師主導治験「希少性神経・筋難病疾患の進行抑制治療効果を得るための新たな医療機器、生体電位等で随意コントロールされた下肢装着型補助ロボット(HAL-HN01)に関する医師主導治験-HTLV-1関連脊髄症(HAM)等の痙性対麻痺症による歩行不安定症に対する短期の歩行改善効果についての多施設共同無作為化比較対照並行群間試験-(NCY200試験)」の結果に基づくもの。同試験では、有効性の主要評価項目として2分間歩行テスト、副次的評価項目として10m歩行テスト(速度)、患者自身による主観的歩行評価(Patient reported outcome measure:PRO)などを評価しました。
医療用HALは、既に筋萎縮性側索硬化症(ALS)などの8つの進行性神経筋難病で承認されていますが、今回、HTLV-1関連脊髄症(HAM)と遺伝性痙性対麻痺の適応追加承認により、現状有効な治療法がない進行性難病よる歩行不安定症や機能障害を改善することが期待されます。
CYBERDYNEはプレスリリースにて「当社では今後、HAMおよび遺伝性痙性対麻痺患者さんに医療用HALによる治療を行った際に各医療機関で診療報酬算定ができるように保険適用に係る手続きを進めます」と述べています。