脊髄性筋萎縮症の乳幼児患者さんに対するスピンラザのオープンラベルRESPOND試験における中間解析データを発表
バイオジェン社は3月6日、ゾルゲンスマ(オナセムノゲンアベパルボベク)による治療後に臨床上のアンメットニーズを有する脊髄性筋萎縮症(SMA)の乳幼児に対する、2年間のスピンラザ治療後の臨床アウトカムと安全性を評価するオープンラベルRESPOND試験に登録した最初の29人の参加者における6ヵ月後のバイオマーカーの中間解析データを発表しました。
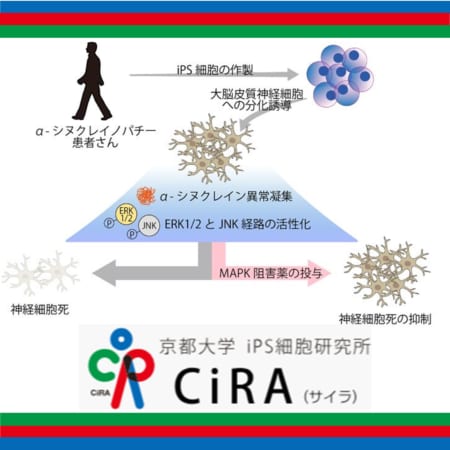
スピンラザは、脊髄性筋萎縮症(SMA)の乳幼児、小児および成人の治療薬です。体内で生成される完全長Survival Motor Neuron (SMN)タンパクの量を継続的に増やすことで、脊髄性筋萎縮症(SMA)の根本原因を標的にするアンチセンス・オリゴヌクレオチド(ASO)です。
今回発表された新たなデータによると、スピンラザの治療を受けた参加者ほぼ全員の軸索損傷と神経変性の客観的なバイオマーカーである血漿ニューロフィラメント軽鎖(NfL)の値が減少しました。これらのデータは、2024年3月3~6日に開催された筋ジストロフィー協会(MDA)2024年度臨床&学術会議にて発表されました。
スピンラザ治療を受けたSMN2遺伝子のコピー数が2の参加者は全員、同様の年齢の健康な小児と比較すると、ベースラインのNfL値が上昇していました。スピンラザ治療6カ月後のNfL値は、最初のスピンラザ投与時の月齢が9カ月以下の乳児では、NfL値がベースラインから平均70%減少しており、9カ月を超えていた小児では、NfL値がベースラインから平均78%減少していました。
また、スピンラザ治療を受けたSMN2遺伝子のコピー数が3の参加者は、3人のうち2人の小児でベースラインのNfL値が上昇していました。ベースラインのNfL値が上昇していた参加者でNfL値の減少が認められ、ベースラインで上昇がなかった参加者のNfL値は安定していました。
2023年6月のSMA研究&治療学会で発表された今回の試験と同じ参加者のデータと同じように、ほとんどの参加者においてハマースミス幼児神経学的検査セクション2(HINE-2)でベースラインからの平均総スコアの改善が認められました。
一方、安全性として、 ゾルゲンスマの治療後にスピンラザを投与されたRESPOND試験の参加者において、新たに発現した安全性の懸念は特定されませんでした。
キングス・ドーターズ小児病院の小児神経科医であるクリスタル・プラウド氏は「遺伝子治療に対する理解が進み、より良いアウトカムの可能性が示されているようです。RESPOND試験でスピンラザ治療後にニューロフィラメント値の減少とともに運動機能の改善が認められたことは、患者さんのベネフィットをより最大化する可能性を示唆しています」と述べています。
また、バイオジェンの開発部門責任者で暫定チーフ・メディカル・オフィサーであるプリヤ・シンハル氏は「バイオジェンは、SMAやALSのような極めて重篤な神経変性疾患の患者さんに対する治療薬の開発を促進するためのバイオマーカーの開発を目的とした先駆的な研究の最前線にいます。RESPOND試験開始時のスピンラザ投与前は、健康な小児と比較して参加者のニューロフィラメント値は上昇しており、神経損傷の進行を示唆していました。RESPOND試験による知見は、既に遺伝子治療を受けたSMA患者に残るアンメットニーズを評価する客観的なマーカーとしてのニューロフィラメントの価値を明確に示すものです」と語っています。
なお、これらのデータとRESPOND試験からの追加データは、SMAヨーロッパが主催する第4回脊髄性筋萎縮症国際会議を含め、今後年内に開催される学会で発表されます。