SOD1遺伝子変異を有する成人ALSに対する初の治療薬QALSODYについてCHMPが肯定的見解を採択
バイオジェンは2月23日、欧州医薬品庁(EMA)の医薬品委員会(CHMP)が、スーパーオキシドジスムターゼ1(SOD1)遺伝子変異を有する成人の筋萎縮性側索硬化症(ALS)治療薬QALSODY(トフェルセン)について、特例的な状況下での販売承認を推奨する肯定的見解を採択したと発表しました。
筋萎縮性側索硬化症(ALS)は、手足・のど・舌の筋肉など呼吸に必要な筋肉が徐々に痩せていき、力がなくなっていく進行性の疾患であり、患者数は世界で16万8000人と推計されていますす。筋萎縮性側索硬化症(ALS)の発症には複数の遺伝子が関わっており、約2%の患者さんがSOD1遺伝子変異を有すると考えられています。SOD1-ALSの患者さんは身体にSOD1遺伝子変異によるSOD1タンパク質の有害な誤った折り畳みを生じます。この有害なタンパク質が、運動ニューロンの変性を発現させ、進行性の筋力低下、機能の喪失、最終的には死に至ります。
QALSODYは、アンチセンスオリゴヌクレオチド(ASO)でSOD1タンパク質の生成を抑制するため、SOD1mRNAに結合するように設計されたSOD1遺伝子変異を有する成人の筋萎縮性側索硬化症(ALS)の患者さんに対する治療薬です。欧州委員会(EC)により承認されれば、QALSODYは運動ニューロン疾患(MND)としても知られる筋萎縮性側索硬化症(ALS)に対し、遺伝的原因を標的とする治療薬として欧州連合(EU)で初めて承認されることになります。
QALSODYを推奨するCHMPの見解は、標的に対する作用機序、バイオマーカー、臨床データを含むエビデンス全体に基づきます。
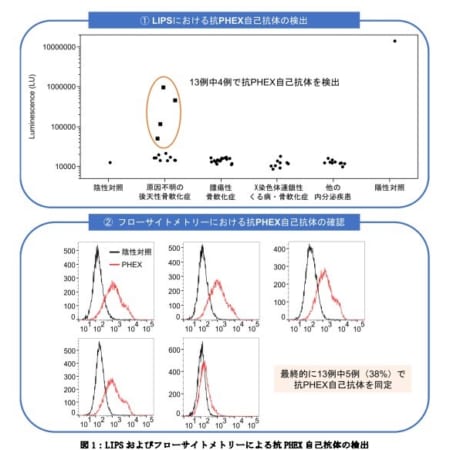
28週間の臨床第III相VALOR試験を行った結果、QALSODYを投与された被験者群とプラセボ群を比較して、QALSODYを投与された被験者群では血漿ニューロフィラメント軽鎖(NfL)の60%減少が認められ、ニューロン損傷の軽減が示唆されました。ALS機能評価スケール改訂版(ALSFRS-R)で評価された身体能力は、QALSODY投与群はプラセボ群と比較して、改善の傾向が見られました。
バイオジェンの開発部門責任者であるプリヤ・シンハル氏は「CHMPの肯定的見解はQALSODYがSOD1-ALS にもたらすインパクトを強固に示すものであり、ALSや神経筋疾患の患者さんのアンメットニーズに対するバイオジェンのコミットメントをより強く表すものです。私たちはSOD1-ALSの臨床試験でニューロフィラメントが果たす役割について新たな知見を導く一助となれることを誇りに思うとともに、ALSコミュニティのために研究の推進に献身的にご協力いただいたSOD1-ALSの患者さん、ご家族の皆さん、そして治療研究に携わった関係者の皆さんに心より感謝いたします」と述べています。
なお、QALSODYに対するCHMPの推奨は今後ECで欧州連合における販売承認が検討され、2024年第2四半期に決定が下される見込みです。
────────────────────────────────────────────────
【レアズからのお知らせ】
ALSの患者さん 臨床研究(インタビューまたはアンケート調査)のご案内
────────────────────────────────────────────────