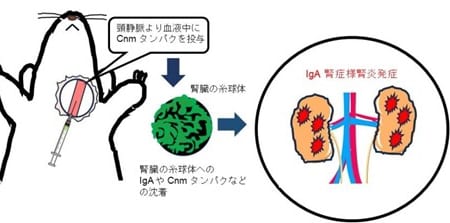
【英国】HYFTORが結節性硬化症に伴う顔面血管線維腫を適応症として販売承認を取得
ノーベルファーマ株式会社は9月1日、HYFTOR(sirolimus 2mg/g gel)が、成人および6歳以上の小児における結節性硬化症に伴う顔面血管線維腫を適応症として英国における販売承認を取得したと発表しました。
結節性硬化症は、皮膚、神経系、腎、肺、骨など全身のさまざまな箇所に良性の腫瘍や先天性の病変ができる遺伝性疾患です。結節性硬化症に伴って発症する、赤みを帯びたニキビのような腫瘍(顔面血管線維腫)は、学童期や思春期に問題になることが多い顔の腫瘍です。
HYFTORは、結節性硬化症に伴う顔面血管線維腫に対して使用される最初の局所ゲル治療剤です。英国では、推計約4,700人の結節性硬化症の患者さんがのうち約3,700人が顔面血管線維腫を有するといわれています。
同剤は、日本においては、結節性硬化症に伴う皮膚病変治療剤「ラパリムス ゲル 0.2%」として2018年より承認、販売されています。 また、 今回の販売承認により、米国、中国、欧州に続く海外製品となりました。
ノーベルファーマ株式会社はリリースにて「HYFTOR(sirolimus 2mg/g gel)の発売により、英国での結節性硬化症に伴う顔面血管線維腫の患者への治療選択肢のひとつになることを期待しています」と述べています。