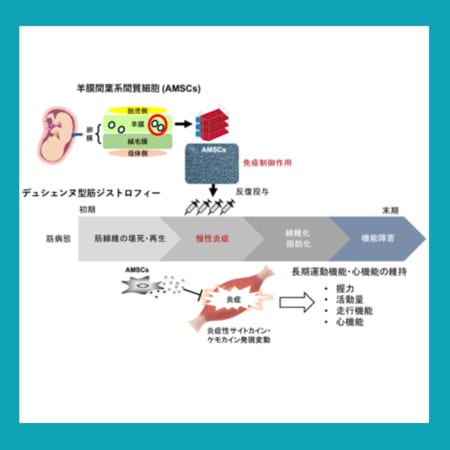
デュシェンヌ型筋ジストロフィー遺伝子治療薬エレビジス、非歩行患者さんへの新たな投与制限を実施
スイス・ロシュ社は6月15日、デュシェンヌ型筋ジストロフィー(DMD)の遺伝子治療薬「エレビジス(一般名:デランディストロゲン・ モキセパルボベック)」について、非歩行患者さんへの新たな投与制限を実施すると発表しました。
この決定は、非歩行のDMD患者さんにおいて2件の致死的な急性肝不全(ALF)が発生したことを受けたもので、これにより非歩行患者におけるエレビジスのベネフィット・リスクプロファイルが不利であると再評価されました。急性肝不全は、エレビジスおよび他のアデノ随伴ウイルス(AAV)媒介性遺伝子治療薬における既知のリスクとされています。
臨床試験では、追加のリスク軽減策(例:免疫調節治療)が研究プロトコルに導入されるまで、非歩行患者さんの登録および投与は直ちに一時停止されます。これまでに世界中で約140名の非歩行患者がエレビジスの投与を受けており、そのうち2名で致死的なALFが発生しました。最初のALF症例を受けて、欧州の規制当局はロシュ社と米サレプタ社に対し、エレビジスに関する臨床試験(Study 104、ENVOL、ENVISION)の一時的な臨床保留を要請しており、これらの保留は現在も有効だといいます。
ロシュ社の最高医学責任者兼グローバル製品開発責任者であるレヴィ・ガラウェイ医師は、「これら2名の若者の逝去に深く悲しみを覚えるとともに、エレビジスの使用に関連するリスクを軽減するために緊急に取り組んでいます。患者の安全は常に私たちの最優先事項です。そのため、非歩行患者へのエレビジスの投与を直ちに中止するよう勧告しました」と述べています。ロシュは関連する保健当局、治験責任医師、処方医と密接に連携し、情報提供と適切な患者ケアの変更を確実にしています。
なお、この新たな投与制限は、年齢に関わらず歩行可能なDMD患者さんの治療には影響しないとしています。エレビジスは日本国内において、2025年5月13日に歩行可能なDMDを対象に厚生労働省より条件及び期限付承認に該当する製造販売承認を取得しています。