パーキンソン病患者から作製したiPS細胞を用いて、αシヌクレイノパチー関連認知症における神経細胞死のメカニズムを解明
京都大学iPS細胞研究所(CiRA)の研究グループは3月28日、認知症を来すαシヌクレイノパチーの一つである家族性パーキンソン病の患者さんから作製したiPS細胞を用いて、神経細胞死を引き起こす分子メカニズムを解明したと発表しました。
パーキンソン病は、動作緩慢、静止時振戦、筋強剛といった運動症状が特徴的で、患者さんのうち約80%は認知機能障害をきたします。認知機能障害は、運動症状と並び、患者さんや家族の生活の質(QOL)を低下する原因となります。パーキンソン病を含むαシヌクレインというタンパク質が蓄積する神経変性疾患であるαシヌクレイノパチー関連認知症は、アルツハイマー病に次いで罹患者数の多い認知症です。αシヌクレイノパチーにおける認知症では、大脳皮質神経細胞の変性と異常凝集したα-シヌクレインタンパク質の蓄積がみられることが知られていますが、なぜ大脳皮質神経細胞の変性が起こるのかはほとんど解明されていません。
また、認知症の主な原因であるレビー小体型認知症においてもパーキンソン病と同様に異常凝集したα-シヌクレインタンパク質の蓄積がみられます。レビー小体型認知症は、パーキンソン病と同様に患者数は増加傾向にありますが、現在の治療法は、対症療法やリハビリテーションが中心です。α-シヌクレイン遺伝子変異を有する家族性パーキンソン病の患者さんの大脳皮質神経細胞死のメカニズムを解明することは、パーキンソン病だけでなくレビー小体型認知症にも進行抑制効果を示す根治的な治療法の開発に貢献できることが期待できるため、今回の研究を実施するに至ったといいます。
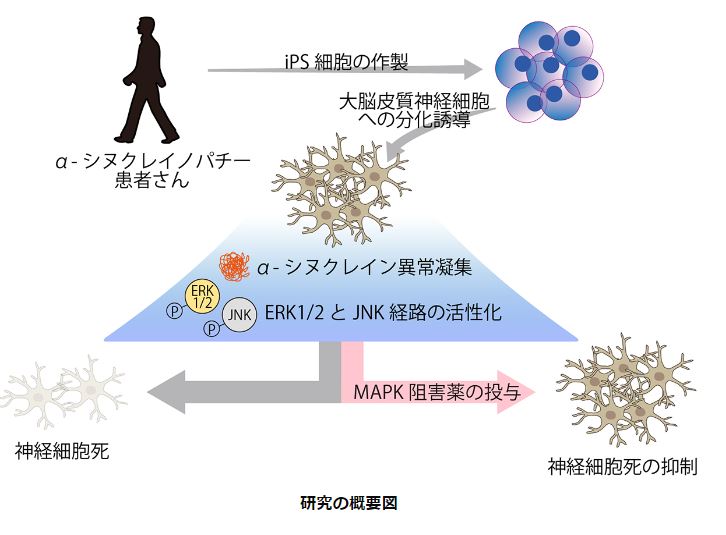
今回、研究グループは、まずα-シヌクレインをコードするSNCA遺伝子にA53T変異をもつ家族性パーキンソン病患者さんの体細胞からiPS細胞を樹立し、高効率な分化誘導法を用いて認知症の発症に関わる大脳皮質神経細胞を作製し、患者さん由来のiPS細胞と健常者由来のiPS細胞それぞれから分化した大脳皮質神経細胞を解析しました。
その結果、患者さん由来の大脳皮質神経細胞では、健常者由来の大脳皮質神経細胞と比べて異常凝集したα-シヌクレインタンパク質の増加、神経突起の伸張障害、神経細胞死の増加がみられました。
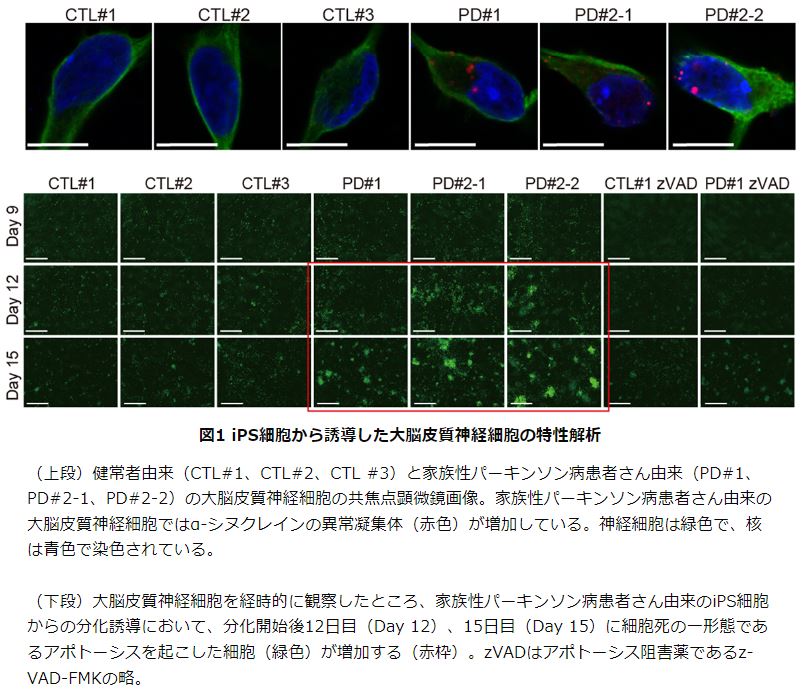
次に、網羅的な遺伝子発現を解析し、患者さん由来の大脳皮質神経細胞でなぜこれらの変化が観察されたのかを詳しく調べました。その結果、MAPキナーゼ経路に関連する遺伝子群の発現が変動していることが判明し、生化学的な解析から、MAPキナーゼ経路のうち、特にERK1/2経路とJNK経路が患者さん由来の大脳皮質神経細胞で活性化していることを見出しました。
さらに、活性化しているERK1/2経路とJNK経路を抑制することで神経細胞死を抑えられるか検証した結果、それぞれの経路に作用する選択的阻害薬の投与により、患者さん由来の大脳皮質神経細胞の細胞死が抑制されました。
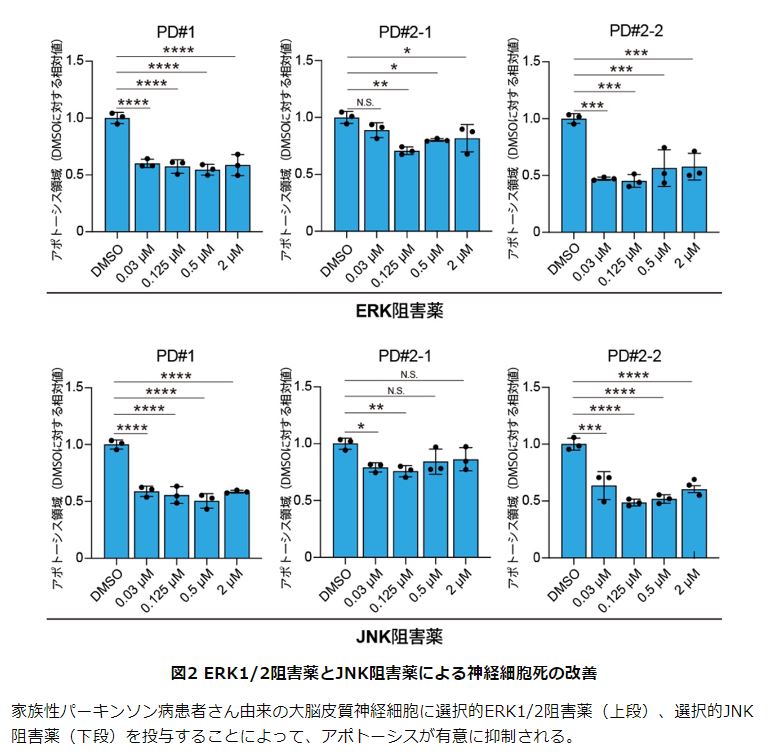
以上の研究成果より、パーキンソン病患者さん由来の大脳皮質神経細胞においてERK1/2経路とJNK経路が活性化していることが発見され、これらの分子経路を抑制することで神経細胞死が改善されることが明らかになりました。αシヌクレイノパチー関連認知症の分子病態の一端が明らかになり、将来的に新たな治療法の開発につながる可能性が期待できるといいます。
なお、同研究の成果は、科学雑誌『Molecular Brain』オンライン版に3月6日付で掲載されました。