iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病の医師主導治験で安全性と有効性の可能性が示唆
京都大学医学部附属病院は4月17日、京都大学iPS細胞研究所(CiRA)と連携し、2018年8月より実施していた「iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病治療に関する医師主導治験」について、その結果がNature誌(2025年4月17日号)に掲載されることになったと発表しました。
パーキンソン病(指定難病6)は、脳内の中脳黒質にあるドパミン神経細胞が減少することで、動作緩慢、筋強剛、静止時振戦といった運動症状を引き起こす神経変性疾患です。初期には薬物療法が有効ですが、長期的な使用に伴い、運動合併症や薬剤誘発性ジスキネジア(不随意運動)といった新たな問題が生じることがあります。このような背景から、失われたドパミン神経細胞を補充する細胞治療が、新たな治療法として注目されてきました。欧米では、ヒト中絶胎児の脳組織を移植する臨床試験が行われてきましたが、倫理的な課題や安定供給の難しさなどが指摘されていました。京都大学iPS細胞研究所の髙橋淳先生らの研究グループは、これまでヒトiPS細胞からドパミン神経細胞を誘導する技術を開発し、サルを用いた実験でその有効性を確認していました。
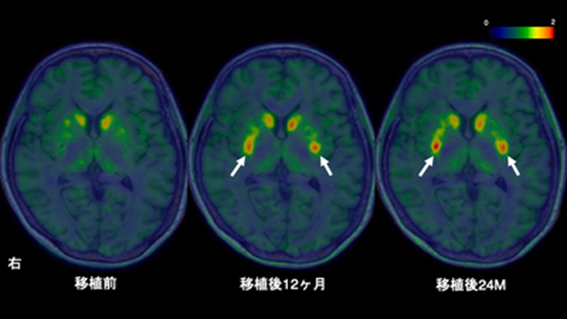
今回の治験では、50歳から69歳までのパーキンソン病患者さん7名に対し、iPS細胞から作製されたドパミン神経前駆細胞を脳内の被殻に両側移植しました。主要な評価項目として安全性と有害事象の発生状況を、副次的な評価項目として運動症状の変化とドパミン産生量を24ヶ月にわたり観察しました。その結果、重篤な有害事象は確認されませんでした。MRIによる画像評価においても、移植された細胞による異常な増殖は見られませんでした。
また、有効性の評価対象となった6名の患者さんのうち、4名において「国際パーキンソン病・運動障害学会統一パーキンソン病評価尺度(MDS-UPDRS)パートIII」のOFFスコアの改善が見られました。さらに、18F-DOPA PETを用いた検査では、被殻におけるドパミン神経の活動が移植後に増加していることが確認されました。これらの結果から、移植されたiPS細胞由来のドパミン神経前駆細胞が生着し、ドパミンを産生し、腫瘍を形成しないことが示され、パーキンソン病に対する安全性と臨床的な有益性が示唆されました。
研究グループは、今後の予定について、「この治療を一日も早く世界中の患者さんにお届けするために、実用化に向けて取り組んでいます。日本国内では、国による承認申請に向けて製薬会社が準備を進めています。海外での実用化も目指し、米国カリフォルニア大学サンディエゴ校では2023年11月から医師主導治験が開始されています」とプレスリリースで述べています。