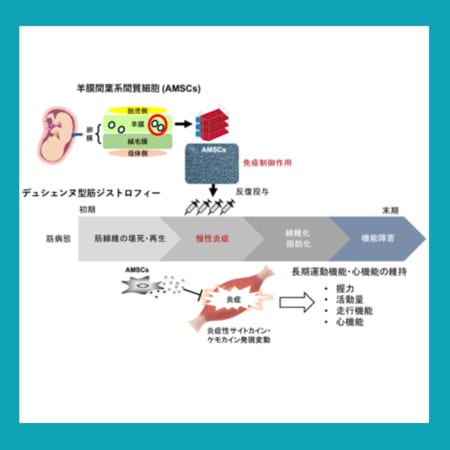
【欧州】ドニダロルセン、成人および12歳以上の青年における遺伝性血管性浮腫(HAE)の再発予防の適応でEMAが申請受理
大塚製薬株式会社は1月6日、米Ionis Pharmaceuticals, Inc. (以下、アイオニス)が遺伝性血管性浮腫の発作抑制薬として開発する「ドニダロルセン(INN:donidalorsen、開発コード: ISIS 721744)」について、成人および12歳以上の青年における遺伝性血管性浮腫の再発予防の適応で、大塚製薬が医薬品販売承認申請(MAA)をし、欧州医薬品庁(EMA)に受理したと発表しました。
遺伝性血管性浮腫(HAE)は、顔(くちびる、まぶた、舌など)、腹部、手足、消化管や喉頭など全身のさまざまな場所が突然腫れる遺伝性疾患です。消化管や喉頭に浮腫が生じれば腹痛や息苦しさが生じ、死に至る可能性があります。5万人に1人といわれるまれな疾患で、そのうちの約75%が家族性と言われています。
ドニダロルセンは、遺伝性血管性浮腫(HAE)発作につながる経路を遮断し、プレカリクレイン(PKK)の産生を抑制するように設計された、RNAを標的とする薬剤です。フェーズ2試験では、遺伝性血管性浮腫(HAE)発作の減少効果と良好な安全性および忍容性が確認されました。フェーズ3試験(OASIS-HAE試験およびOASISplus試験)では、オートインジェクターによる自己投与時を含め、月平均の遺伝性血管性浮腫(HAE)発作率の有意かつ持続的な減少など、複数の評価項目においてドニダロルセンが良好な結果を示しました。
大塚製薬はプレスリリースにて、「常染色体優性多発性嚢胞腎(ADPKD)などを対象とした希少疾患治療薬をグローバルに展開しています。RNAを標的とした創薬のリーディングカンパニーであるアイオニスが創製した本剤を、欧州および日本を含むアジア地域のHAE患者さんにお届けすることで、アンメットメディカルニーズに貢献してまいります」と述べています。
なお、ドニダロルセンは米国および欧州では希少疾病用医薬品に指定されており、2024年11月、アイオニス社は米国食品医薬品局(FDA)が同剤の新薬承認申請(NDA)を受理したと発表しました。