SOD1遺伝子変異を有する筋萎縮性側索硬化症(ALS)治療薬クアルソディが製造販売承認を取得
バイオジェン・ジャパン株式会社は12月27日、「クアルソディ髄注100mg」(一般名:トフェルセン)について、「SOD1遺伝子変異を有する筋萎縮性側索硬化症における機能障害の進行抑制」の適応症で、製造販売承認を取得したと発表しました。
筋萎縮性側索硬化症(指定難病2、ALS)は、手・足・のど・舌の筋肉や呼吸に必要な筋肉が徐々に痩せて力がなくなっていく疾患です。筋萎縮性側索硬化症(ALS)の発症には複数の遺伝子が関わっており、SOD1遺伝子変異は、全世界の筋萎縮性側索硬化症(ALS)の推計罹患者数16万8000人の約2%に関わっていると言われています。筋萎縮性側索硬化症(ALS)患者さんのうち15%以上の方々が遺伝子変異によるものと考えられていますが、日本ではSOD1遺伝子変異が最も多く、約30%を占めています。
アンチセンスオリゴヌクレオチド(ASO)であるクアルソディは、SOD1タンパク質の生成を抑制するためにSOD1 mRNAに結合するように設計されています。 筋萎縮性側索硬化症(ALS) の遺伝的原因を標的とする治療薬としては、日本で初めて承認されました。
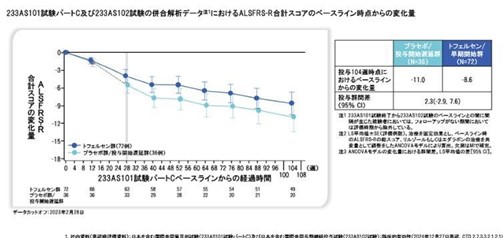
今回の承認は、SOD1-ALS患者さんを対象とした無作為化プラセボ対照第III相試験(VALOR試験)及び非盲検長期継続投与試験の結果に基づいたものです。VALOR試験の主要評価項目は、疾患進行が急速な被験者群における投与28週時点のALSFRS-R合計スコアのベースラインからの変化量でした。
同剤投与群とでプラセボ投与群と比較して、ALSFRS-Rの低下は小さい傾向にありましたが、統計学的に有意な差は示しませんでした。しかし、非盲検長期継続投与試験との併合解析では、いずれの評価時点及び解析対象集団においても同剤群では対照群と比較して、ALSFRS-R合計スコアのベースラインからの変化量が小さい傾向にありました。また同剤群では、死亡または永久人工呼吸器装着の発現割合が低い傾向にありました。これらの結果により、治療選択肢が限られているSOD1-ALSに対して、同剤の有効性が期待できると判断されたといいます。
クアルソディの投与を受けた被験者で報告された主な副作用は、脊髄炎(3.4%)、神経根炎(2.7%)、視神経乳頭浮腫(4.8%)、無菌性髄膜炎(4.1%)、頭痛(13.6%)、髄液細胞増加症(8.2%)、錯感覚(6.1%)、CSF蛋白増加(22.4%)、CSF白血球数増加(14.3%)、四肢痛(17.7%)、筋肉痛(10.2%)、疲労(5.4%)、処置による疼痛(6.8%)でした。
バイオジェン・ジャパンの傳幸諭社長氏はプレスリリースにて、「本日、私たちは治療法がなかった日本のSOD1-ALSの患者さん及びご家族に治療薬をお届けできることをうれしく思っています。臨床試験で示された有効性と安全性のプロファイルに基づき、クアルソディが、重篤な疾患を抱える患者さんに有意義な影響を及ぼすことができると信じています。ALSに苦しむ人々の生活と人生を変えるという当社のミッションの一環として、私たちはクアルソディの恩恵を享受すべき人々が確実に、かつ速やかにこの治療薬にアクセスできるよう、遺伝子検査の浸透も含めて、治療体制を整えるべく努力してまいります」と述べています。