シャペロン群による新たなアミロイドの脱凝集メカニズムを解明、アルツハイマー型認知症やハンチントン病など神経変性疾患の創薬開発に繋がる可能性
理化学研究所の共同研究グループは12月20日、酵母シャペロンタンパク質のアミロイドへの結合部位を決定し、新たなアミロイドの脱凝集メカニズムを解明したと発表しました。
アルツハイマー型認知症やハンチントン病などの神経変性疾患では、原因タンパク質の凝集に伴って線維状の凝集体(アミロイド)が形成されるという特徴があります。アミロイドが脳内に存在する細胞から周りの細胞へと伝播することが、神経変性疾患の発症や進行に関わっていると考えられています。これまで研究グループは、酵母プリオンの系を用いて研究を行いました。細胞間伝播に重要なアミロイドの脱凝集にはSsa1のほかSis1、Hsp104という三つのシャペロンタンパク質の関与が示唆されていることは明らかになりましたが、脱凝集の詳しいメカニズムは不明なままでした。
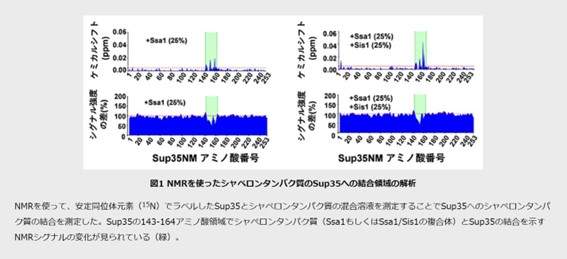
今回、共同研究グループは安定同位体元素でラベルしたSup35と高度に精製したシャペロンタンパク質を用いて核磁気共鳴法(NMR)によって、Sup35アミロイド内におけるSsa1、Sis1、Hsp104の各シャペロンタンパク質の結合部位を調べました。その結果、Sup35アミロイドにSsa1のみを加えたときと、Ssa1とSis1の両方を加えたときは同じ部位(143-164番目のアミノ酸)に結合することが判明しました。一方、Sis1のみを加えたときの結合部位(181-193と212-222番目のアミノ酸)は、Ssa1の結合領域とは異なりました。
この結果からSsa1とSis1は複合体を形成し、143-164番目のアミノ酸領域に結合することでアミロイドの脱凝集を開始させることが示唆されました。そこでSsa1の結合部位を欠損させたSup35アミロイドを作製し、Ssa1/Sis1/Hsp104シャペロンタンパク質によるアミロイドの脱凝集を蛍光分子チオフラビンTでモニターしたところ、Ssa1の結合部位を欠損させたSup35アミロイドでは、Ssa1/Sis1/Hsp104の添加で蛍光が下がらず、シャペロンタンパク質による脱凝集が抑制されました。
次に、アミロイドの構造が野生型のSup35と異なるS17R変異体のアミロイドを脱凝集実験に用いたところ、脱凝集されないことが判明。Sup35の野生型アミロイドと比較して、通常、酵母シャペロンタンパク質による分断効果が低いのですが、このS17R変異体アミロイドでも、脱凝集が促進されることを見出しました。
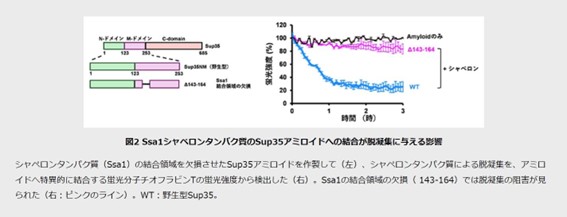
さらに、それぞれ別の蛍光色素で標識したS17R変異体のアミロイドとS17R変異体にSsa1の結合領域を付与したM1[S17R]アミロイドを用いて、Ssa1またはHsp104の結合を蛍光顕微鏡下で観察したところ、S17R変異体アミロイドへはシャペロンタンパク質の結合がほとんど見られないのに対して、M1[S17R]変異体アミロイドでは各シャペロンタンパク質の結合が見られたといいます。
これらの結果は、S17R変異体のアミロイドコア(81-148アミノ酸領域)から離れた部位にSsa1結合領域を付加させることで、本来脱凝集できないS17R変異体のアミロイドでも脱凝集させることができることが示唆されています。また、HAP/ClpPというタンパク質を分解する酵素をHsp104の代替としたハイブリッド酵素を用いることで、野生型のSup35アミロイドだけでなく、S17R変異体のアミロイドも、脱凝集にとどまらず、分解もすることができたとしています。
以上の研究成果より、酵母プリオンSup35アミロイドの脱凝集の過程で、アミロイドコアから離れ露出したアミノ酸領域へのSsa1の結合が重要であることが明らかになりました。シャペロンタンパク質による脱凝集や分解は、新たな治療戦略として期待できるといいます。
なお、同研究の成果は、「Proceedings of the National Academy of Sciences(PNAS)」に12月10日付で掲載されました。