老化と神経変性疾患に共通する分子基盤が明らかに
東京医科歯科大学の研究グループは8月6日、金沢大学との共同研究により、老化と神経変性疾患の関連性の分子基盤を明らかにしたと発表しました。
アルツハイマー病、パーキンソン病、脊髄小脳失調症、筋萎縮性硬化症などの神経変性疾患の多くは、中年期から老年期になって発症することから、老化が神経変性疾患の最大のリスク因子と考えられています。しかし、老化はDNA損傷集積、テロメア短縮、酸化ストレスや終末糖化産物の集積、さまざまな酵素活性低下など複雑な側面を持っており、神経変性病態と老化病態の関係性は十分に解明されていません。
研究グループは、20年以上前に、神経変性疾患の主要カテゴリーのひとつであるポリグルタミン病(脊髄小脳失調症1型やハンチントン病を含む10種類以上の神経変性疾患が含まれる神経変性疾患グループ)の原因タンパク質と結合して細胞毒性の起点となる正常タンパク質を網羅的にスクリーニングし、PQBP1,、PQBP3、,PQBP5、,VCPなどのタンパク質を発見しました。
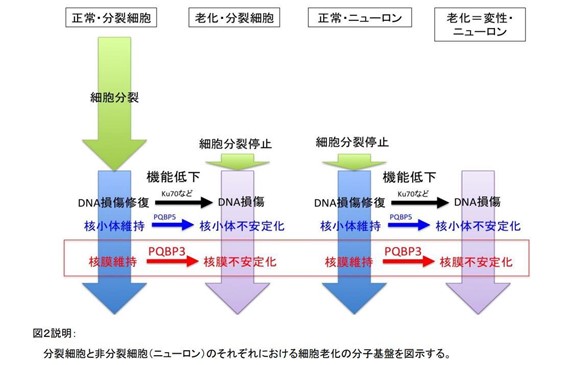
今回、研究グループは、細胞老化においてはPQBP3が細胞核から減少すること、神経変性疾患病態においてはPQBP3が疾患タンパク質と結合して細胞核から減少すること、核膜の安定性を保つ機能を持つことを示し、ニューロンの細胞老化と変性病態がPQBP3機能低下という点で共通していることを最終的に示しました。
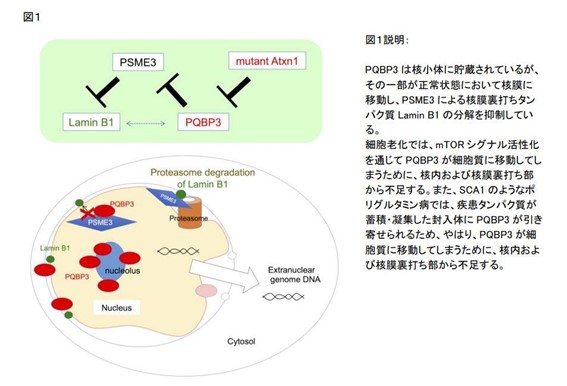
PQBP3は通常は核内の核小体の周辺部に局在していましたが、細胞が培養皿中で満杯状態になって細胞分裂を休止した時、あるいは、細胞培養で継代を繰り返したために細胞分裂が停止した時では、核小体から核質あるいは細胞質に移動しました。このPQBP3細胞内局在のシフトは、オートファジーシグナルにも関係するmTORによって影響を受けていました。さらに、過酸化水素によって細胞老化の状態を誘導した際にも、PQBP3の細胞質シフトが起こりました。また、この局在シフトには核DNAの細胞質への漏出を伴っており、このようなPQBP3が細胞質に移動した細胞を電子顕微鏡で観察すると、核膜形態が不安定化していることがわかりました。
PQBP3の機能低下は脳ニューロンにおいて細胞老化と神経変性の両病態で起きうるため、PQBP3を標的にすることで、脳老化と脳神経変性の両者を改善することが理論的に可能です。一方、ニューロン以外の分裂細胞では、PQBP3はがんのリスク因子として報告されており、これは細胞老化ががんを抑制するというがん研究領域の常識と一致します。つまり、PQBP3は“両刃の劍(諸刃の劍)“であり、がんと神経変性という対照的な細胞病態という生物学の根本的問題とも関わるため、ニューロン選択性の高い発現調節機構を利用するなどの技術的な工夫が必要と考えられます。
以上の研究成果より、PQBP3の機能低下が、老化と神経変性疾患病態の関連性を分子レベルで説明できることを示しました。
今回の研究成果の重要性は、老化と神経変性の両病態に共通する新しい分子基盤を解明したことにあるとしています。
なお、同研究の成果は、国際科学雑誌「The EMBO Journal」オンライン版に8月5日付で掲載されました。