慢性骨髄性白血病治療薬で筋萎縮性側索硬化症(ALS)の進行が停止、第1相試験で確認
京都大学iPS細胞研究所(CiRA)は10月1日、筋萎縮性側索硬化症(ALS)を対象に慢性骨髄性白血病治療薬であるボスチニブの安全性と忍容性を評価した「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験(iDReAM試験:iPSC-based Drug Repurposing for ALS Medicine study)」の結果を発表しました。
この研究は、同研究所の井上治久教授、徳島大学病院脳神経内科の和泉唯信教授、京都大学医学部附属病院脳神経内科の髙橋良輔教授、北里大学病院脳神経内科の永井真貴子診療准教授、鳥取大学医学部附属病院脳神経内科の渡辺保裕准教授ら研究チームによるもの。同チームはこれまでにALS患者さんのiPS細胞を用いて、2012年にALS病態の再現、2017年に薬剤スクリーニングのためのiMNシステムを開発し、ボスチニブが強い抗ALS病態作用を有することを見出していました。
iDReAM試験では、12名の患者さんを対象にALS特有の有害事象が生じる可能性がないか調べるため、まず3名のALS患者さんに1日量100mg投与し、その結果を安全性評価委員会で評価を行った後、次に別のALS患者さん3名に1日量200mg、同様に次に別のALS患者さん3名に1日量300mg、次に別のALS患者さん3名に1日量400mgを投与しました。
その結果、ボスチニブ1日量100~300mgを投与されたALS患者さん9名が12週間の試験を完了。1日量400mgを投与されたALS患者さん3名が有害事象によって試験を完了しませんでした。全体を通じての有害事象は、下痢、肝機能障害などでした。治験実施計画書に規定した基準に基づき、適切なボスチニブの投与調整や支持療法による管理が必要な場合があったそうです。
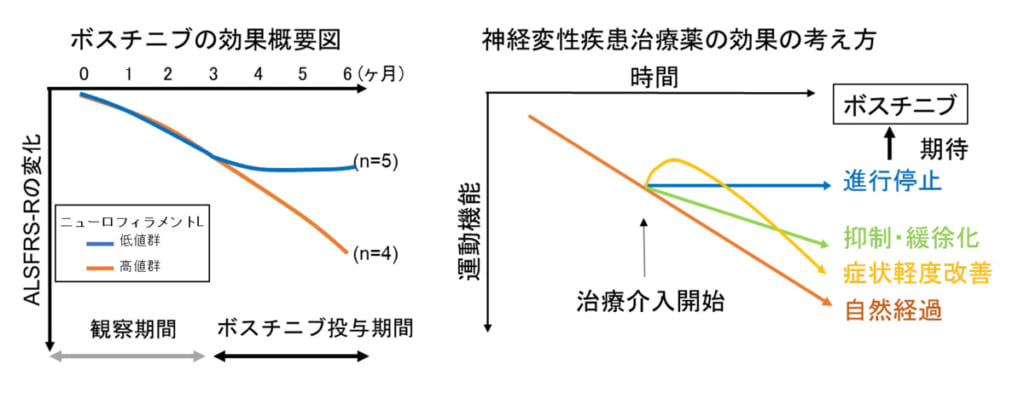
また、ALS患者さんにおけるボスチニブの有効性を探索するため、ALSの症状の進行を示す指標であるALS機能評価スケール改訂版(ALS functional rating scale-revised)の変化を調べたところ、ボスチニブを12週間内服された9名のうち5名の患者さんで、ボスチニブ内服後にALSFRS-Rスコアの低下が停止していることが判明。ALSFRS-Rの低下が見られた4名と、ALSFRS-Rの低下の停止がみられた5名の血液を調べたところ、ボスチニブ投与前のニューロフィラメントLという物質の量が異なっていることがわかったそうです。
これらの結果から、ALS患者さんで認められた有害事象の種類は慢性骨髄性白血病と同様であり、ボスチニブの100~300mgの用量レベルでの忍容性は良好であることがわかりました。探索的有効性解析では、ボスチニブの投与期間において一部の患者さんでALSの進行の停止がみられ、その目印となる可能性がある指標があることが明らかになりました。その一方で、今回の臨床試験に参加した患者さんの数は少ないため、更なる検討が必要としています。
なお、ボスチニブはALSを適応症として日本を含めた世界各国で承認されておらず、ALSに対する有効性、安全性ならびに適切な用量は確立していません。そのため、ボスチニブは現時点でALSの治療薬として使用できる状況にありません。
研究グループはプレスリリースにて、「今後、多くの患者さんでボスチニブの有効性を調べるために、十分な安全性を考慮した上で、次相以降の試験を行うことを計画しています。将来的には、現在研究を進めているAIを用いた疾患予測技術と合わせてALS制圧を目指していきたいと考えています」と述べています。











