酸性スフィンゴミエリナーゼ欠損症(ASMD)治療薬候補olipudase alfa、世界初となる承認申請を日本で実施
サノフィ株式会社は9月30日、成人および小児における酸性スフィンゴミエリナーゼ欠損症(ASMD)の非中枢神経系病変に対する治療法として同社が開発を進めているヒト酸性スフィンゴミエリナーゼ製剤「olipudase alfa」について、世界で初めて日本で承認申請をしたと発表しました。
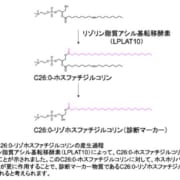
ライソゾーム病の一種である酸性スフィンゴミエリナーゼ欠損症(ASMD)は、スフィンゴミエリンホスホジエステラーゼ1の遺伝子(SMPD1)の変異によって生じるさまざまな疾患の総称であり、そのスペクトラムの両端にある疾患は、NPD A型とNPD B型と呼ばれることもあります。ニーマン・ピック病(NPD)A型およびB型とも呼ばれることもあります。ASMDの全世界での発症率は、出生児10万人あたり0.4~0.6人とされています。
olipudase alfaは、活性が低下している酸性スフィンゴミエリナーゼ(ASM)を補充し、スフィンゴミエリンの分解を促す目的で用いる開発中の酵素補充療法の製剤。日本では、olipudase alfaは、先駆け審査指定制度の対象品目に指定されています。なお、NPD A型の患者を対象とした同剤の試験は行われていません。
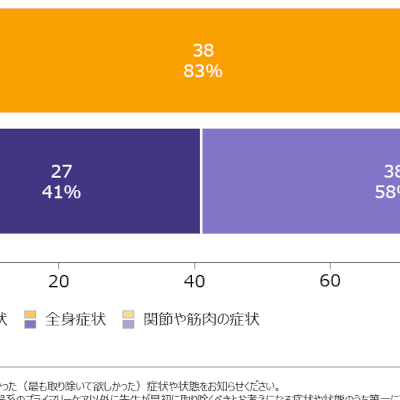
今回の承認申請は、2つの臨床試験で得られた肯定的な結果に基づくもの。ASMDの成人患者さん36名が参加した第II/III相試験であるASCEND試験では、52週間にわたり、olipudase alfaの肺機能、脾容積と肝容積等に対する効果をプラセボとの比較で検討しました。
ASMDの小児患者さん(出生後~18歳未満)20名を対象とした第I/II相非盲検単群試験であるASCEND-Peds試験では、64週間にわたりolipudase alfaの安全性と忍容性を評価しました。なお、両試験結果は2020年10月に開催された第70回米国人類遺伝学会(ASHG 2020)で発表されています。