世界初のミトコンドリア病治療薬「MA-5」第II相臨床試験を開始、症状改善と難聴の治療薬開発につながる可能性
東北大学、順天堂大学、東京医療センター、自治医科大学、日本医療研究開発機構(AMED)、杏林製薬株式会社は11月19日、世界初のミトコンドリア病治療薬である「Mitochonic acid-5(ミトコニック アシッド 5、以下MA-5)」の医師主導第ⅡII相臨床試験を、2025年12月から国内4医療機関で開始すると発表しました。
ミトコンドリア病(指定難病21)は、生命活動に必要なエネルギー(ATP)の約95%を産生するミトコンドリアの機能異常により引き起こされる疾患です。ミトコンドリアは全身の有核細胞に存在するため、脳、心臓、腎臓などあらゆる臓器に障害が起きる進行性の希少難病ですが、これまで有効な治療薬はありませんでした。
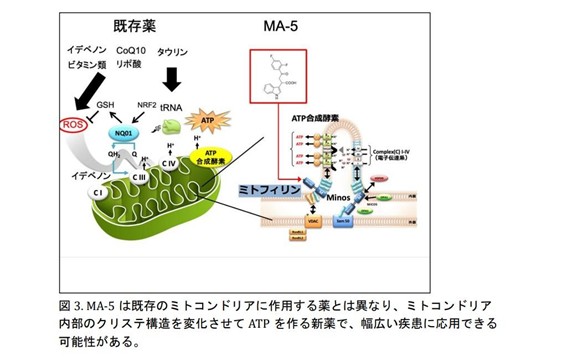
MA-5は、東北大学が開発した化合物です。MA-5は、ミトコンドリア内膜の折りたたみ構造(クリステ)を維持する重要なタンパク質であるミトフィリンに結合し、ATPを合成する酵素の複合体の重合を促進することで、ATP産生の効率を高めるという新しいメカニズムを持っています。
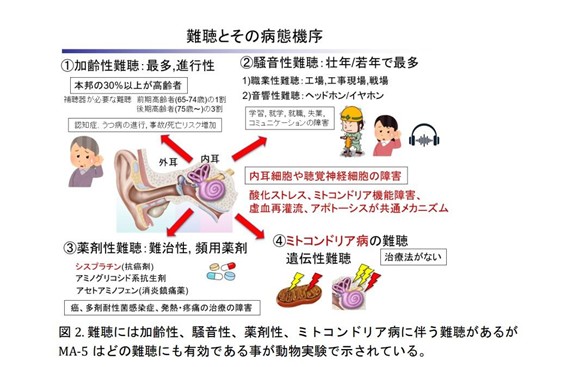
これまでの研究では、MA-5がミトコンドリア病のモデル動物において、生存率の低下や神経障害、腎機能障害、肝機能障害、運動障害などの症状を改善することが認められています。また、ミトコンドリアの機能異常はミトコンドリア病患者の難聴に加え、加齢性難聴、騒音性難聴、薬剤性難聴にも関与することが知られていますが、MA-5は各種マウス難聴モデルやヒトiPS細胞由来内耳細胞を使った研究で、難聴にも有効なことが示されています。
今回の医師主導第ⅡII相臨床試験は、難聴を有するミトコンドリア病患者さんを対象とし、プラセボ(偽薬)対照、二重盲験、多施設参加型探索的試験として実施されます。実施機関は、順天堂大学医学部附属順天堂医院、東北大学病院、国立病院機構東京医療センター、自治医科大学附属病院の国内4施設です。治験では、患者さんに異なる量のMA-5またはプラセボを服用してもらい、安全性、薬物動態、そしてミトコンドリア病の各種症状や聴力に対する有効性を探索的に評価します。
この臨床開発は、治療薬のない希少難病であるミトコンドリア病の進行抑制と、難聴の改善に寄与することが期待されています。同治験によって、MA-5がミトコンドリア病の症状改善および難聴の治療薬開発につながる可能性があり、将来的には加齢によるミトコンドリア機能低下に伴う各種疾病(サルコペニア、認知症、パーキンソン病など)の発症予防や治療への応用も期待されています。











