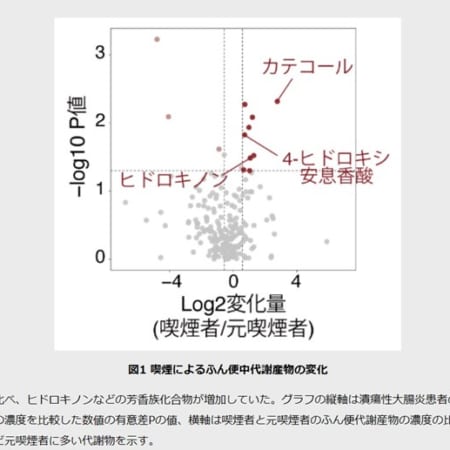
脊髄性筋萎縮症(SMA)治療薬スピンラザ、高用量投与レジメンの承認を申請
バイオジェン・ジャパン株式会社は2月28日、脊髄性筋萎縮症(SMA)治療薬であるヌシネルセン(製品名:スピンラザ)の高用量投与レジメンについて、日本国内で承認申請を行ったと発表しました。
脊髄性筋萎縮症(指定難病3、SMA)脊髄の前角細胞が変化し、進行性の筋力低下と筋萎縮を特徴とする疾患です。
ヌシネルセンは、脊髄性筋萎縮症(SMA)の乳幼児、小児および成人の治療薬として世界71カ国以上で承認されています。ヌシネルセンは体内で生成される完全長Survival Motor Neuron (SMN)タンパクの量を継続的に増やすことで、運動ニューロン喪失の根本原因を標的にするアンチセンス・オリゴヌクレオチド(ASO)です。脊髄性筋萎縮症(SMA)の発症部位に到達できるよう、運動ニューロンが存在する中枢神経系に直接投与されます。現在、全世界で14,000人以上の脊髄性筋萎縮症(SMA)患者さんがヌシネルセンによる治療を受けています。
ヌシネルセンの高用量投与レジメンは、初期投与レジメン(50mgを14日間隔で2回投与)と維持投与レジメン(4ヵ月ごとに28mg投与)で構成されています。なお、現在承認されている同剤のレジメンは12 mgです。
また、ヌシネルセンの高用量投与レジメンについては、米FDAが承認申請(sNDA)を受理し、また欧州委員会(EMA)からも申請内容の検証の結果、受理されたことが2025年1月23日に発表されています。