【欧】ファセンラ、好酸球性多発血管炎性肉芽腫症(EGPA)に対する追加療法として承認を取得
英アストラゼネカ社は10月28日、ファセンラ(ベンラリズマブ)について、再燃性または難治性の好酸球性多発血管炎性肉芽腫症(EGPA)を有する成人患者さんに対する追加療法として欧州連合(EU)の承認を取得したと発表しました。
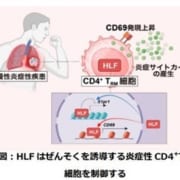
好酸球性多発血管炎性肉芽腫症(指定難病45、EGPA)は、気管支喘息やアレルギー性鼻炎が先行症状として現れ、その後、血液中の好酸球が増加し、血管に炎症を起こす疾患です。肺、上気道、皮膚、心臓、消化管、神経などの複数の臓器に障害を引き起こす可能性があり、治療を行わないと死に至る場合もあります。
ファセンラは、好酸球性多発血管炎性肉芽腫症(EGPA)を治療するために承認された2番目の生物学的製剤です。2024年9月に好酸球性多発血管炎性肉芽腫症(EGPA)に対して米国で承認を取得しています。
今回の承認は、欧州医薬品評価委員会の肯定的な見解に沿ったものであり、The New England Journal of Medicine誌で発表された第III相MANDARA試験の肯定的な結果に基づいたものです。
MANDARA試験は、好酸球性多発血管炎性肉芽腫症(EGPA)患者さんを対象として生物学的製剤を直接比較する初めての非劣性試験です。4週ごとに、ファセンラ30mgを単回皮下注射する群、またはメポリズマブ100mgを3回皮下注射する群に患者さんを無作為に割り付けました。
同試験では、ファセンラ投与患者さんの約60%が寛解を達成し、これはメポリズマブ投与患者さんと同等でした。また、データではファセンラ投与患者さんの41%が経口ステロイド(OCS)を漸減して完全に中止したことも示されました(メポリズマブ群では26%(差:16%、95%CI:1,31))MANDARA試験におけるファセンラの安全性および忍容性のプロファイルは、本剤の既知のプロファイルと一致していました。
MANDARA試験の治験責任医師でもあるBernhard Hellmich氏はプレスリリースにて、「EGPA患者さんは、消耗性症状や臓器障害に苦しみ、死亡に至ることもあります。今日の承認によって、EUのEGPA患者さんは重要な治療選択肢が得られることになります。ベンラリズマブによって好酸球性炎症を直接標的として除去することで、より多くの患者さんが寛解を達成し、重篤かつ長期間副作用を引き起こす可能性のある経口ステロイドへの依存を低減できることを願っています」と述べています。
また、アストラゼネカ社のエグゼクティブバイスプレジデント兼バイオファーマ研究開発部門の責任者であるRuud Dobber氏は、「引き続き、治療が困難な疾患を抱える患者さんの支援に尽力していきます。今日のファセンラの承認は、注射の頻度が月1回と利便性が高く、EGPA患者さんにとって前向きな一歩です。ファセンラは何千人もの重症好酸球性喘息患者さんにとって長年にわたり十分に確立された治療薬であり、欧州のEGPA患者さんにとって待望の治療選択肢を提供できるようになったことを嬉しく思います」と述べています。