筋萎縮性側索硬化症(ALS)患者さんを対象とした第2相試験でボスチニブが主要評価項目を達成
京都大学iPS細胞研究所(CiRA)、徳島大学、京都大学、北里大学、鳥取大学、奈良県立医科大学、東邦大学、広島大学らの研究グループは6月12日、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第2相試験(iDReAM試験:iPSC-based Drug Repurposing for ALS Medicine Study)」を行い、ボスチニブの有効性と安全性を評価したと発表しました。
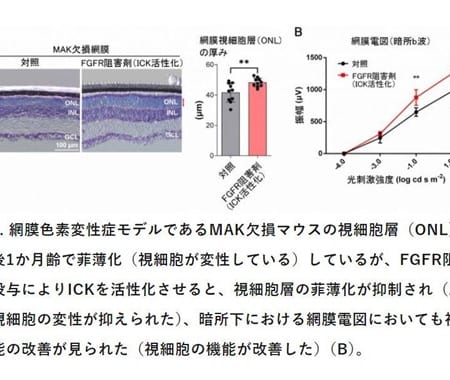
筋萎縮性側索硬化症(指定難病2)は、手足・のど・舌などの呼吸に必要な筋肉が徐々にやせて力がなくなっていく疾患です。経過に個人差はありますが、症状が進行すると、人工呼吸器が必要になります。筋萎縮性側索硬化症(ALS)の進行を緩和する既存薬はありますが、いまだ筋萎縮性側索硬化症(ALS)の進行を止める根本的治療は確立されていません。
これまで、研究グループは、筋萎縮性側索硬化症(ALS)患者さん由来のiPS細胞から作製した運動神経細胞を用いて、筋萎縮性側索硬化症(ALS)の病態を再現できることを見出し、筋萎縮性側索硬化症(ALS)の病態の中核である運動神経細胞の細胞死と異常タンパク質の蓄積を抑えることができる化合物のスクリーニングを行うiMNシステムを構築しました。このシステムを用いて、既に他の疾患で治療薬として用いられている物質を含むさまざまな種類の化合物をスクリーニングした結果、強い抗ALS病態効果を有するボスチニブを同定したことを報告しました。
さらに、2019年から2021年まで、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験」(iDReAM試験)を行い、ボスチニブに筋萎縮性側索硬化症(ALS)特有の有害事象は認められなかったこと、ボスチニブの投与期間に一部の患者さんで筋萎縮性側索硬化症(ALS)の進行の抑制が認められたこと、その目印となる可能性のある指標があったことを見出しました。
2022年に、約25名の筋萎縮性側索硬化症(ALS)患者さんを対象に、ボスチニブの24週間投与時の有効性および安全性を評価する第2相試験を行いました。
筋萎縮性側索硬化症(ALS)患者さんに、1日量200mgもしくは300mgのボスチニブを投与した結果、主要評価項目では、筋萎縮性側索硬化症(ALS)の承認薬であるエダラボンの臨床試験(MCI186-19)のプラセボ群に基づく基準と比較し、運動機能障害の強さを示すALSFRS-Rのスコアの低下が抑制されていることが示されました。副次評価項目では、有効性に関して事前に定めた基準を達成した項目と達成に至らなかった項目がありました。
有害事象においては、下痢、肝機能障害などが認められました。これらの有害事象は、治験実施計画書に規定した基準に基づき、ボスチニブの用法用量の調整や支持療法による管理が必要な場合がありました。
探索的評価として実施したレジストリ(JaCALS)データとの比較において、ボスチニブの有効性が示唆されました。また、筋萎縮性側索硬化症(ALS)のバイオマーカーである血漿中ニューロフィラメントL(NFL)の値は、過去のレビュー論文(多くの論文の結果をまとめた論文)によると、発症後は平均すると一定の値で推移することがわかっています。
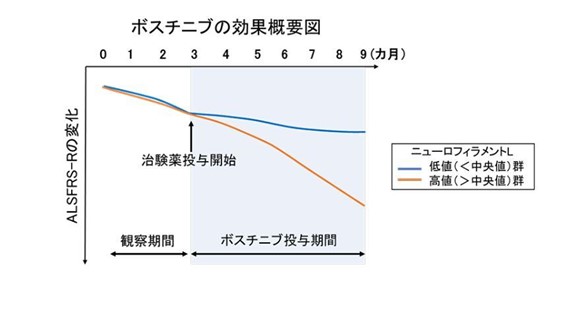
同治験においては、血漿中NFLの値を観察期間(ボスチニブ投与開始前)と治験薬投与期間で測定したところ、治験薬投与後、患者さんのNFLの平均値が治験薬投与前の平均値よりも低下していました。しかし、観察期間にNFLの自然低下を示した患者さんもいました。
さらに、ボスチニブの24週間の投与において、探索的に行った評価において、第1相試験の結果と同様に、以下のように一部の患者さんで筋萎縮性側索硬化症(ALS)の進行の抑制が認められる結果が得られました。
以上の研究成果より、ボスチニブの有効性が示唆されました。また、安全性に関しては筋萎縮性側索硬化症(ALS)特有の有害事象は認められなかったとしています。
────────────────────────────────────────────────
【レアズからのお知らせ】
ALSの患者さん 臨床研究(インタビューまたはアンケート調査)のご案内
────────────────────────────────────────────────