多発性嚢胞腎を対象にRAR作動薬タミバロテンを治療薬候補として前期第二相臨床試験を開始
京都大学iPS細胞研究所(CiRA)は2月29日、京大発スタートアップ企業であるリジェネフロ社が京都大学iPS細胞研究所(CiRA)の研究成果をもとに、RAR作動薬であるタミバロテンを常染色体顕性(優性)多発性嚢胞腎(ADPKD)治療の開発品として選定し、多発性嚢胞腎(ADPKD)患者さんを対象とした前期第II相臨床試験を開始したと発表しました。
多発性嚢胞腎(ADPKD)は、腎臓内に多数の嚢胞が形成され、腎臓の機能が低下する難病です。進行すると、人工透析や腎移植を必要とする末期腎不全に至ります。多発性嚢胞腎(ADPKD)の患者さんの腎嚢胞は、糸球体や腎尿細管上皮より発生することもありますが、主に集合管から発生します。多発性嚢胞腎(ADPKD)の治療薬として唯一承認されているトルバプタンは、疾患の進行を止めることはできません。また、トルバプタンは腎集合管でのバソプレシンによる水再吸収を阻害することで水利尿作用を示すため、1日に多量の飲水が必要です。
これまで世界各国で、多発性嚢胞腎(ADPKD)の新規治療薬の開発が行われてきましたが、トルバプタンと同じ作用メカニズムの開発品や、異なるメカニズムの開発品での臨床試験では、ヒトにおける有効性ならびに安全性が検証できた薬剤はありませんでした。そのため、新たな治療法の開発が望まれています。
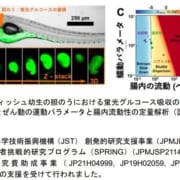
今回、研究グループは、iPS細胞から腎集合管オルガノイドを作製し、難病である多発性嚢胞腎(ADPKD)の病態モデルを作製することに成功しました。また、このモデルを活用して、嚢胞形成を強力に抑制する薬剤の候補として、レチノイン酸受容体(RAR)作動薬を同定することに成功し、その治療効果を複数の多発性嚢胞腎(ADPKD)マウスモデルで確認しました。
リジェネフロ社は、日本国内において再発・難治性の急性前骨髄球性白血病(APL)の治療薬として既に承認されているタミバロテンを多発性嚢胞腎(ADPKD)の治療薬候補として選定しました。その理由として、タミバロテンは非臨床毒性試験は実施済みであり、急性前骨髄球性白血病(APL)以外の疾患についても、臨床試験にてヒトに対する投与経験が豊富であることから、ヒトにおける安全性プロファイルは確立しているものと考えられたことが背景にあります。
再発・難治性の急性前骨髄球性白血病(APL)治療においては、高用量のタミバロテンを短期間集中的に投与することにより、分化症候群などの重大な副作用が報告されていますが、アルツハイマー型認知症患者さんを対象とした医師主導臨床試験おいては、急性前骨髄球性白血病(APL)治療よりも低用量のタミバロテン4mgを1日1回24週間経口投与した場合では、死亡例などの重篤な有害事象は報告されませんでした。これらのことから、医薬品医療機器総合機構(PMDA)の助言を受けて、追加の非臨床毒性試験や第一相臨床試験を新たに実施することなく、2023年12月より前期第二相臨床試験を開始しました。
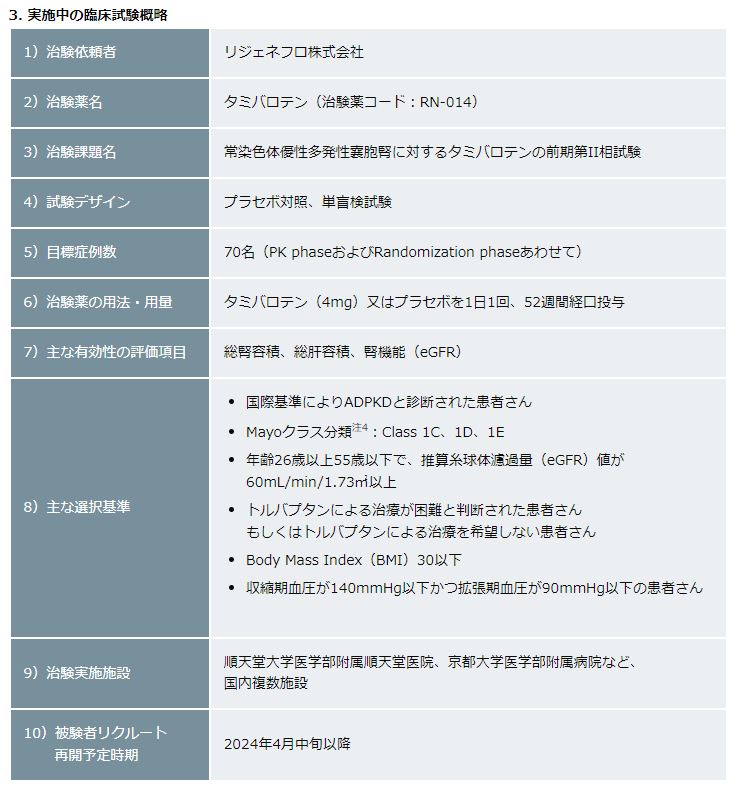
現時点では、被験者リクルートは一旦中断していますが、PK Phaseにおける投与後8週間までの安全性・忍容性に問題ないことを効果安全性評価委員会が確認後、2024年4月中旬以降に被験者リクルートを再開する予定です。
今回の臨床試験において、タミバロテンの有効性ならびに安全性が確認されれば、タミバロテンの作用メカニズムはトルバプタンとは異なりますので、多量の飲水が必要ない等、多発性嚢胞腎(ADPKD)治療における患者さんの生活の質を向上することが期待できるといいます。
リジェネフロ社は今後の展望について「ADPKD患者さんを対象とした前期第二相臨床試験を2023年12月から実施しています。本臨床試験においてタミバロテンの有効性ならびに安全性が確認されれば、パートナーとなる製薬企業と提携を結び、グローバル臨床試験に進む予定です。タミバロテンが日本およびグローバルでADPKD治療薬として上市されれば、ADPKD治療におけるQuality of Lifeを改善することが期待されます。今回の臨床試験はiPS細胞から作製した病態モデルから創薬するiPS創薬の新しい事例となります。リジェネフロ社は今後もCiRAやパートナー企業と緊密に連携しながら、ADPKDをはじめとする腎臓、肝臓、膵臓領域の複数の難病に対するiPS創薬を推進してまいります」と述べています。