【米国】クローン病治療薬リサンキズマブがウステキヌマブとの直接比較試験において、臨床的寛解ほか良好な結果を達成
アッヴィ合同会社は11月7日、1種類以上の抗TNF-α抗体製剤による治療が不成功であった中等症から重症の活動性クローン病患者さんを対象に、リサンキズマブ(販売名:スキリージ)の有効性および安全性をウステキヌマブ(販売名:ステラーラ)と直接比較し評価する第III相SEQUENCE試験で良好な結果が得られたと、米アッヴィ社がリリースを行ったことを発表しました。
クローン病は、消化管に炎症が起きることにより、持続的な下痢や腹痛をきたす慢性、全身性疾患であり、進行性の疾患です。症状が強く現れる活動期と治療により症状が治まっている寛解期を繰り返し、徴候・症状は予測できないため、患者さんにとって身体面だけでなく精神面、経済面にも大きな負担となることがあります。
リサンキズマブは、クローン病、乾癬性関節炎および乾癬の治療薬として承認されたIL-23阻害薬です。炎症プロセスに関与するサイトカインであるIL-23は、多くの慢性免疫関連疾患に関連すると考えられています。現在、中等症から重症の潰瘍性大腸炎の成人患者さんの治療薬としての評価が進められています。
SEQUENCE試験は、1種類以上の腫瘍壊死因子(TNF)阻害薬による治療不成功(不耐容または効果不十分)の既往歴がある中等症から重症のクローン病を有する成人患者さんを対象として、48週間のパート1では、リサンキズマブ群(0週、4週および8週時に600mgを静脈内投与後、12週時とその後8週間ごとに360mgを皮下投与)またはウステキヌマブ群(体重換算用量での単回静脈内投与、その後8週間ごとに90mgを皮下投与)のいずれかに無作為に割り付けました。パート2では、有害事象の報告を行うため、パート1においてリサンキズマブの投与を受け、48週時の来院を完了した患者さんを対象に、リサンキズマブのSC投与をさらに220週間継続しました。
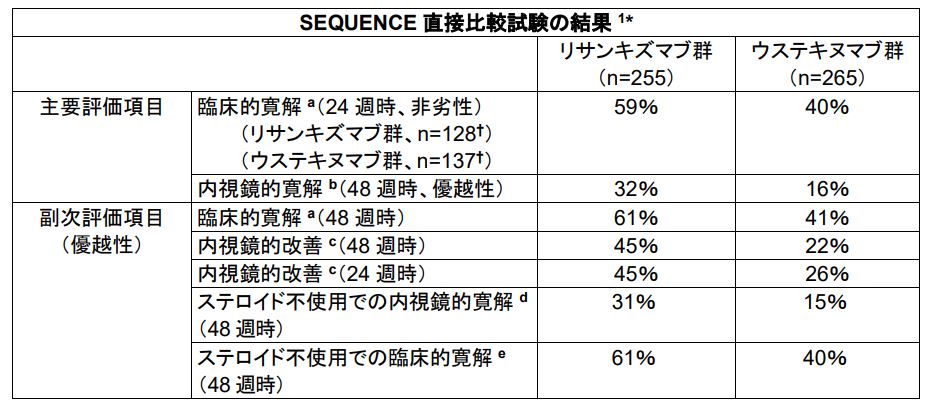
SEQUENCE試験の第1の主要評価項目である24週時の臨床的寛解の結果は、リサンキズマブ群の寛解率59%に対し、ウステキヌマブ群の寛解率は40%であり、リサンキズマブのウステキヌマブに対する非劣性が示されました。
さらに、第2の主要評価項目である48週時の内視鏡的寛解の結果は、リサンキズマブ群の寛解率は32%に対し、ウステキヌマブ群の寛解率は16%であり、リサンキズマブのウステキヌマブに対する優越性が示されました。
また、順位付けされたすべての副次評価項目の結果は、リサンキズマブのウステキヌマブに対する優越性が示されました。
SEQUENCE試験におけるリサンキズマブの安全性プロファイルは、これまでに確認されているリサンキズマブの安全性プロファイルと一致しており、新たな安全性のリスクは認められませんでした。
アッヴィのsenior vice president, development and regulatory affairs兼chief medical officer であるRoopal Thakkar氏は「アッヴィは、炎症性腸疾患などの免疫介在性疾患と共に生きる患者さんの治療を前進させるために薬剤の開発とエビデンスの構築に取り組んでいます。今回の結果は、クローン病管理のための治療選択肢としてスキリージを差別化するだけでなく、患者さんの治療戦略に有用なさらなる情報提供となり、この治療領域の進化につながるものでもあります」と述べています。
なお、同研究の成果は、2023年10月14日から17日にかけて開催された欧州消化器病(UEG)週間において発表されました。











