リツキサンが既存治療で効果不十分なループス腎炎に対する適応追加の承認を取得
中外製薬株式会社と全薬工業株式会社は8月23日、両社で共同販売を行っている抗CD20モノクローナル抗体「リツキサン点滴静注100mg、同500mg」(一般名:リツキシマブ(遺伝子組換え)以下、リツキサン)について、「既存治療で効果不十分なループス腎炎」に対する適応追加の承認を、全薬工業が厚生労働省より取得したと発表しました。
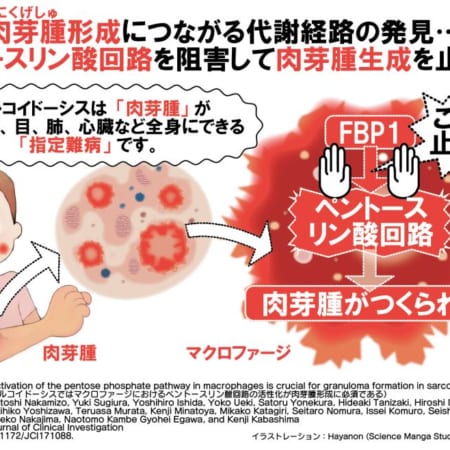
ループス腎炎は、全身性エリテマトーデス(SLE)によって生じる腎臓病変です。主要な臓器病変の中でも高頻度で発現し、全身性エリテマトーデス(SLE)の予後を左右する臓器合併症の1つです。国内の患者数は約6~10万人と言われていますが、その中でループス腎炎の発症頻度は45~86%と報告されています。ループス腎炎は、免疫調節機構の異常により、免疫応答の障害が持続して腎障害が引き起こされると考えられています。
リツキサンは、造血幹細胞や形質細胞以外のB細胞上に発現するタンパク質であるCD20抗原に特異的に結合する抗CD20モノクローナル抗体です。ループス腎炎の病態の中心となる自己抗体産生や免疫複合体の形成に関与するB細胞を、ヒトの体内に備わった免疫系を用いて攻撃し、細胞を傷害することにより、腎症状の改善に繋がります。
今回の承認取得の背景として、 一般社団法人日本リウマチ学会からの要望を受け、「既存治療で効果不十分なループス腎炎」に対するリツキサンの効能または効果の追加に対し、医療上の必要性の高い未承認薬・適応外薬検討会議ならびに薬事・食品衛生審議会医薬品第一部会の決定に基づき公知申請を行っていました。
全薬工業および中外製薬は、リリースにて「既存治療で効果不十分なループス腎炎に対する治療にリツキサンが貢献できるよう、より一層の協力体制で取り組んでまいります」話しています。