特発性肺線維症(IPF)および進行性肺線維症(PPF)治療薬候補ネランドミラスト単剤療法で死亡リスクを59%低下
独ベーリンガーインゲルハイム社は 9月29日、開発中の経口薬ネランドミラスト(BI 1015550)に関するグローバル第III相試験「FIBRONEERプログラム」から得られた新たなデータを発表しました。
ネランドミラストは、特発性肺線維症(IPF)や進行性肺線維症(PPF)といった難治性の肺疾患の治療薬候補として研究が進められている、優先的ホスホジエステラーゼ4B(PDE4B)阻害剤です。
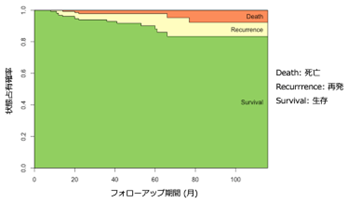
FIBRONEER-IPF試験およびFIBRONEER-ILD試験の主要評価項目(努力肺活量(FVC)で測定した呼吸機能の低下の抑制)は達成されましたが、初回急性増悪や呼吸器疾患による入院、または死亡が生じるまでの期間を評価する主な副次的評価項目は達成されませんでした。
今回発表されたFIBRONEER両試験の併合解析結果では、ネランドミラストが特発性肺線維症(IPF)および進行性肺線維症(PPF)における死亡リスクを有意に低下させることが明らかになりました。特に、既存治療薬を併用せずにネランドミラスト18mgの投与を受けた患者さんにおいて、プラセボと比較して死亡リスクが有意に59%低下しました。ニンテダニブを併用している患者さんでも、死亡リスクは有意に41%低下しています。
ネランドミラストの安全性と忍容性プロファイルは、これまでの臨床試験データと同様の傾向を示しており、有害事象による投与中止の割合はプラセボ群と同等でした。最も多く見られた有害事象は下痢で、単剤療法群のネランドミラスト18mg投与群で27.4%に報告されています。
現在、ネランドミラストは特発性肺線維症(IPF)の治療薬として米国食品医薬品局(FDA)から優先審査の対象に指定されており、審査終了目標日は2025年第4四半期中とされています。進行性肺線維症(PPF)における新薬承認申請も提出済みであり、欧州連合(EU)、中国、英国でも薬事申請が審査中です。
なお、今回のデータは、アムステルダムで開催された2025年欧州呼吸器学会(ERS)にてポスター発表されたものです。