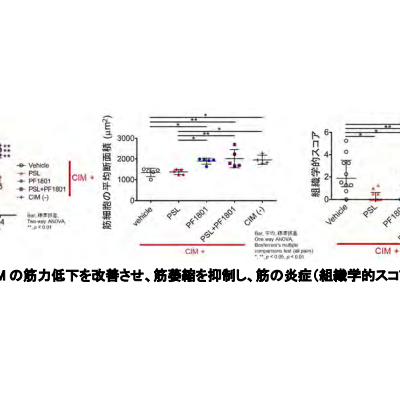
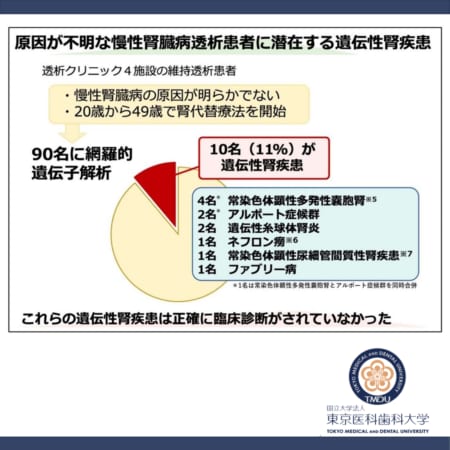
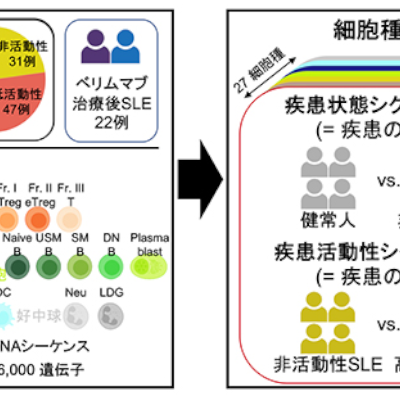
ドラベ症候群の治療薬候補zorevunersenの開発と商業化に関する提携契約を締結
米バイオジェン社と米ストーク・セラピューティクス社は2月18日、ドラベ症候群の治療薬として開発中のzorevunersenについて、開発と商業化に関する提携契約を締結したと発表しました。今回の契約締結により、ストーク社は米国、カナダ、メキシコにおけるzorevunersenの独占権を保持し、バイオジェン社はその他の国・地域における商業化の独占権を取得しました。
ドラベ症候群(指定難病140)は、乳児期に発症し、その後も全身又は半身けいれんが続く疾患です。現在、承認済みの治療薬は存在せず、難治性で長期的予後は不良です。米国、英国、欧州連合主要4カ国、および日本で最多で38,000人の患者さんがいると言われています。
Zorevunersenは、ほとんどのドラベ症候群の根本原因であるSCN1A遺伝子を標的とする開発中のアンチセンスオリゴヌクレオチド(ASO)です。
ストーク社は、米国、欧州、日本の各規制当局との協議で合意が得られたことを受けて、zorevunersenの申請に向けた国際共同第III相臨床試験(EMPEROR)を開始する計画を発表しました。同試験は、2025年第2四半期に開始する予定で、2027年下半期にピボタルデータのリードアウトを見込んでおり、これを受けて全世界での承認申請が可能になるものと期待されます。
ストーク社の最高経営責任者で医師であるエドワード・M. ケイ氏はプレスリリースにて、「バイオジェンの神経疾患領域における深い経験と、希少な遺伝性疾患に対する高価値の疾患修飾薬を全世界で成功裏に商業化してきた実績により、私たちはzorevunersenの恩恵を受け得る全ての患者様にこの薬剤をお届けすることで、ドラベ症候群の治療を新たな時代へと導くことを目指します。さらにこの提携が当社の財務状況に合わさることで、2028年半ばまで当社を支えるキャッシュフローをもたらしてくれます」と述べています。
また、バイオジェンの開発部門の責任者であるプリヤ・シンハル氏は、「この提携により第III相臨床試験直前の疾患修飾薬候補が加わることでバイオジェンの後期段階のパイプラインを拡大し、希少疾患治療薬の商業化で世界的な実績のある当社の知見を活かすことを可能にします。既に標準治療薬を投与されている患者さんの発作の減少と認知機能および行動機能を測る複数の指標の改善は、ドラベ症候群の根本原因を標的とする初の疾患修飾薬としてのzorevunersenの可能性を示唆するものです」と述べています。