rilzabrutinibが、免疫性血小板減少症(ITP)の第III相試験でBTK 阻害剤として初めて臨床的有益性を示す
仏サノフィ社は12月7日、免疫性血小板減少症(ITP)の成人患者さんを対象に行ったrilzabrutinibの第III相LUNA3試験で肯定的な結果が得られ、BTK阻害剤である同剤が免疫性血小板減少症(ITP)に対するファースト・イン・クラスの治療薬となる可能性が高まったと発表しました。
免疫性血小板減少症(ITP)は、抗体ができて血小板が破壊されることにより、血小板減少をきたす疾患です。特発性血小板減少性紫斑病(指定難病63)とも呼ばれます。
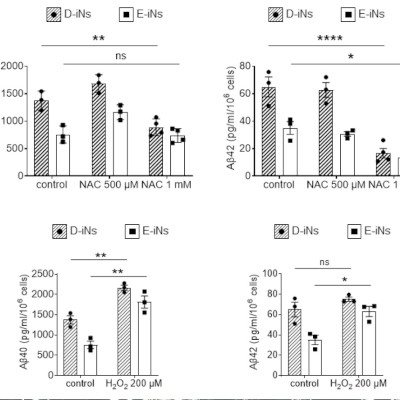
第III相LUNA3試験では、持続性または慢性の免疫性血小板減少症(ITP)がみられ、血小板数がきわめて低い(中央値15,000/µL)成人患者さんが最長で24週間にわたりrilzabrutinibの1回400mg1日2回経口投与(n=133)もしくはプラセボの経口投与(n=69)を受けた後、28週間の非盲検治療を受けました。その結果、血小板反応が得られた患者さんの割合は、rilzabrutinib投与例では65%(n=86)、プラセボ投与例では33%(n=23)でした。
同試験で主要評価項目を達成し、持続的な血小板反応が得られた患者さんの割合はrilzabrutinib群では23%、プラセボ群では0%でした。また出血の減少、血小板反応が得られた週数、レスキュー治療の実施状況や、身体的疲労やQOL(生活の質)の評価項目などの主な副次評価項目も達成しました。
rilzabrutinibの安全性プロファイルは、過去の試験結果と同様の内容でした。有害事象においては、rilzabrutinib投与例、プラセボ投与例とも発現率は同程度でした。rilzabrutinib投与例で発現率が高かった有害事象は、いずれも軽度~中等度(グレード1/2)で、下痢(23%)、悪心(17%)、頭痛(8%)と腹痛(6%)などでした。
サノフィ社 最高医学責任者およびグローバル開発ヘッドのディートマー・ベルガー氏はプレスリリースにて、「今回新たに得られたデータは、rilzabrutinibが免疫性血小板減少症に対して強固で持続性のある血小板反応をもたらす可能性を裏づけ、治療選択肢が限られる患者さんに希望をお届けする内容です。本剤は、様々な免疫細胞で重要な役割を果たす酵素であるBTKを標的とする薬剤であり、幅広い希少血液疾患や自己免疫疾患の患者さんの転帰改善につながる可能性があります」と述べています。
なお、試験結果は、2024年12月7~10日にサンディエゴで開催された第66回米国血液学会議(ASH 2024)にて発表されました。