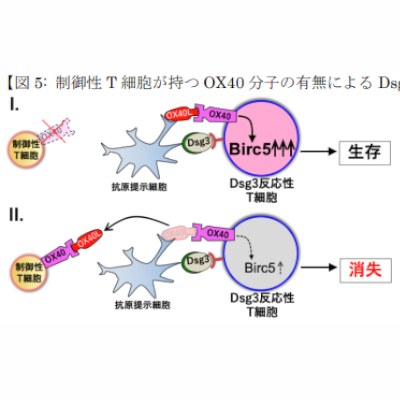
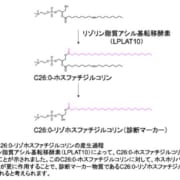
開発中のBTK阻害薬Tolebrutinib、再発を伴わない二次性進行型多発性硬化症(nrSPMS)における障害蓄積の遅延を示す
仏サノフィ社は9月2日、開発中のブルトン型チロシンキナーゼ阻害薬(BTKi)tolebrutinibについて、再発を伴わない二次性進行型多発性硬化症(nrSPMS)の患者さんを対象とした第III相HERCULES試験で肯定的な結果を示し、主要評価項目を達成したと発表しました。
多発性硬化症(指定難病13)は、免疫介在性の慢性神経変性疾患で、時間的・空間的に病変が多発するのが特徴です。身体機能や認知機能が低下することで、健康状態や生活の質(QOL)が徐々に低下し、患者さんのケアや余命に影響が及びます。再発型多発性硬化症(RMS)は、寛解と再発を繰り返します。再発を伴わない二次性進行型多発性硬化症(nrSPMS)は、再発がみられなくなるものの、疲労、認知障害、平衡障害や歩行障害、排尿・排便障害や性機能障害などの障害が徐々に蓄積する状態を指します。
多発性硬化症(MS)の現在の治療法の主な標的は末梢循環中のB細胞とT細胞ですが、障害蓄積への関与が考えられる自然免疫に対しては現在の治療法はほとんど対応できないため、障害蓄積が大きなアンメットメディカルニーズとしてあります。現在、多発性硬化症(MS)を適応症として承認されている薬剤や多発性硬化症(MS)を対象に開発中の治療薬候補は、主に獲得免疫系を標的としたものか、中枢神経系に直接作用することなく臨床的有益性を得ることを目標とした薬剤です。
Tolebrutinibは、開発段階にある経口投与が可能で脳透過性のブルトン型チロシンキナーゼ阻害薬(BTKi)で、中枢神経系においてBリンパ球と疾患関連ミクログリアに対して作用を発現する濃度に到達します。
第III相HERCULES試験では、再発を伴わない二次性進行型多発性硬化症(nrSPMS)を試験開始時点のEDSSスコアが3.0~6.5、過去24カ月間に臨床的な再発がなく、過去12カ月間に障害蓄積の所見がみられる二次性進行型多発性硬化症(SPMS)と定義。主要評価項目として持続する障害進行(CDP)の発現までの時間をtolebrutinibとプラセボで比較。その結果、CDPの発現までの時間延長が認められました。また、肝臓における安全性に関する予備解析の結果は、tolebrutinibについて既に行われた試験の結果と同様でした。
一方、再発型多発性硬化症(RMS)の患者さんを対象にtolebrutinibを評価した第III相試験であるGEMINI1およびGEMINI2試験では、年間再発率(ARR)を主要評価項目としてteriflunomideと比較しましたが、主要評価項目を達成しませんでした。しかし、重要な副次評価項目である6カ月持続する障害悪化(CDW)発現までの時間について併合解析した結果、発現時期の遅延が認められ、HERCULES試験で認められたCDPデータを裏づける結果が得られました。
また、一次性進行型多発性硬化症を対象に現在実施中の第III相PERSEUS試験の結果は、2025年に得られる見込みとしています。
サノフィ社の研究開発担当ヘッドであるホーマン・アシュラフィアン氏はプレスリリースにて、「tolebrutinibは、障害蓄積に対して臨床上意義あるベネフィットをもたらす、本疾患に対する初の治療選択肢となることが期待される革新的な治療薬候補です。くすぶり型の神経炎症によって引き起こされると考えられる障害蓄積は、nrSPMSの患者さんにとって大きなアンメットメディカルニーズです」と述べています。
HERCULES、GEMINI1およびGEMINI2の試験結果は、2024年9月20日にデンマーク・コペンハーゲンで開催される欧州多発性硬化症学会(ECTRIMS)で発表予定。なお、tolebrutinibは現在、臨床開発段階にあり、その安全性と有効性は、いずれの規制当局でも評価されていません。