ICF症候群の原因遺伝子CDCA7が新規の片鎖メチル化DNA結合タンパク質であることが明らかに
横浜市立大学は8月26日、東京大学医科学研究所と米ロックフェラー大学との共同研究により、免疫不全・セントロメア不安定症候群(ICF症候群)の原因遺伝子であるCDCA7とHELLSが、ヘテロクロマチン領域のDNAメチル化の維持に働く分子機構を明らかにしたと発表しました。
哺乳類のシトシンに起こるDNAメチル化は遺伝子発現のオン・オフを決め、細胞の形質を決める細胞記憶として働きます。この仕組みが破綻すると、異常な発生・分化に加えて、細胞のがん化や染色体不安定化を引き起こすことで、さまざまな疾患の原因になると考えられています。そのため、DNAメチル化維持の分子機構の全貌を明らかにすることは、科学的にも社会的にも重要な課題です。
ICF症候群は、DNAのメチル化異常が関与する疾患のひとつで、クロマチンリモデリング因子HELLSとその活性化因子CDCA7の変異を原因とし、ヘテロクロマチンの低メチル化を特徴とする疾患です。これまで、CDCA7がDNAメチル化にどのように関与し、ICF症候群で見られるCDCA7変異がなぜDNA低メチル化を引き起こすのかは明らかになっていませんでした。
今回、研究グループは、アフリカツメガエルの卵抽出液を用いた実験から、CDCA7は第2の片鎖メチル化DNA結合タンパク質であることを明らかにしました。UHRF1はヌクレオソーム中の片鎖メチル化DNAに結合できませんが、CDCA7はヌクレオソーム中の片鎖メチル化DNAに強固に結合できることがわかり、UHRF1とは異なる結合特性を持つことがわかりました。
この認識機構を明らかにするために、片鎖メチル化サイトを持つヌクレオソームとCDCA7の複合体構造をクライオ電子顕微鏡単粒子解析を決定し、CDCA7がヌクレオソーム中の片鎖メチル化サイトに結合している様子を捉えることに成功しました。ICF症候群に関与するCDCA7のアルギニン274は、直接的に片鎖メチル化サイト中の5メチルシトシンの認識に関与し、さらにアルギニン304はDNAのリン酸骨格の認識に関与していました。
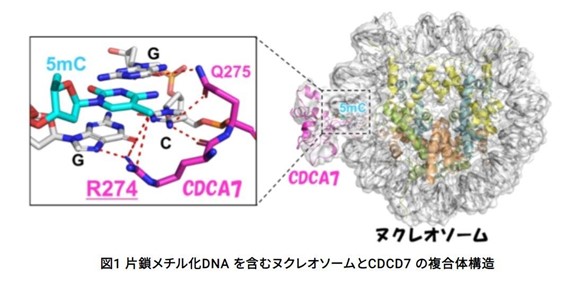
さらに、アフリカツメガエルの卵抽出液を用いた実験から、片鎖メチル化DNAの結合能を失ったCDCA7は、下流で働く維持メチル化因子の正しい局在に異常をきたすため、DNA低メチル化が起こることがわかりました。
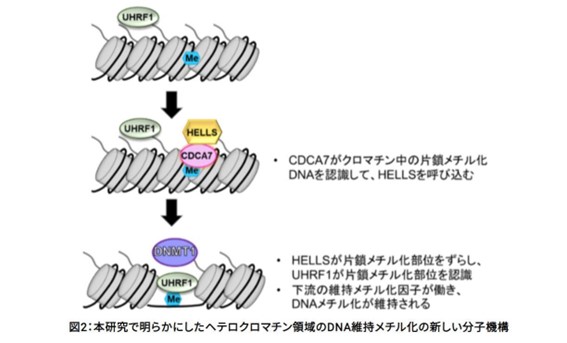
今回の研究により、研究グループは、ICF症候群の原因遺伝子であるCDCA7が片鎖メチル化DNAを認識することを明らかにし、DNAメチル化維持の制御の新しい分子メカニズムを提唱しました。UHRF1は複製時に一時的に生じる片鎖メチル化DNAに特異的に結合し、ヒストンH3をユビキチン化します。このユビキチン化H3がDNMT1のDNAメチル化部位局在に不可欠な役割をします。これに加えて新たにヘテロクロマチン領域の維持メチル化では、以下のことが起こることがわかりました。
1)CDCA7はヌクレオソーム中の片鎖メチル化DNAに結合してHELLSを呼び込む
2)HELLSのクロマチンリモデリング活性によって片鎖メチル化サイトがヌクレオソームからずらされて、リンカーDNA上に露出する
3)UHRF1がリンカーDNA上の片鎖メチル化サイトに結合しヒストンH3をユビキチン化して、DNMT1をクロマチンに呼び込む
以上の研究成果より、クライオ電子顕微鏡単粒子解析によって、ICF症候群の発症に関与するCDCA7のアミノ酸残基が片鎖メチル化DNAを認識することが分かり、ICF症候群で見られるCDCA7変異によってもたらされるDNA低メチル化の分子機構が明らかになりました。これらの発見は、ICF症候群の病態メカニズム解明や新たな治療法開発に繋がる可能性があると期待されます。
なお、同研究の成果は、「Science Advances」に8月24日付で掲載されました。