IgA腎症の発症に腸上皮バリアの破綻が関与、マウスモデルで実証
慶應義塾大学の研究グループは8月5日、福島大学、静岡県立大学、理化学研究所との共同研究により、腸上皮バリアの破綻がIgA腎症の発症の原因となることをマウスモデルにより初めて実証したと発表しました。
IgA腎症(指定難病66)は、慢性糸球体腎炎の1つで、血液中の老廃物や塩分のろ過装置である糸球体に炎症が生じ、機能が低下する疾患です。進行すると、透析や腎移植が必要となる場合があります。炎症の原因は、糸球体へのIgA抗体の沈着ですが、なぜIgAが沈着するかは明らかになっていませんでした。
消化吸収を行う腸管には、食事により摂取された食物抗原や病原体などが存在し、これらの異物が体内へ侵入するのを防ぐシステムが必要です。この腸上皮バリア機能が低下することによって、腸内の物質が体内に入り込む「リーキーガット(腸漏れ)」と呼ばれる状態になります。リーキーガットは、自己免疫疾患やアレルギー疾患、肥満などの疾患と関連している可能性が指摘されていますが、実際にリーキーガットがこれらの疾患の発症原因であるか否かは明らかになっていませんでした。IgA腎症も、リーキーガットとの関連が示唆されています。
今回、研究グループは、薬剤処理により腸上皮細胞からAP-1Bを欠損させたマウスを作製し、AP-1B欠損が腸上皮バリア機能にどのような影響を与えるかを詳細に解析しました。その結果、AP-1B欠損は血中デキストラン濃度を顕著に増加させました。また、AP-1B欠損マウスの腸管では抗菌ペプチド産生量の低下、管腔内IgA濃度の低下が認められました。このことから、腸上皮細胞におけるAP-1B欠損は腸上皮バリア機能を低下させ、リーキーガットと似た症状を招くことが明らかになりました。
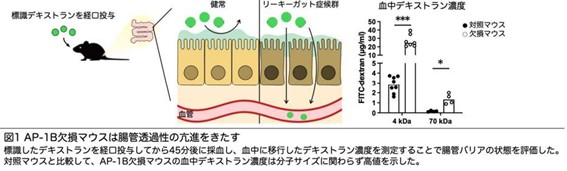
次に、AP-1B欠損によって腸上皮バリア機能の低下が引き起こされる原因を明らかにするため解析を行いました。その結果、AP-1B欠損マウスでは、抗菌ペプチドの産生を制御するサイトカインであるインターロイキン-22(IL-22)シグナルの低下、管腔内へのIgA分泌を担う多量体免疫グロブリン受容体(pIgR)の発現を誘導するIL-17シグナルの低下が認められました。また、AP-1Bによるタンパク質の選別輸送が、腸上皮バリア機能の維持に重要であることが明らかになりました。
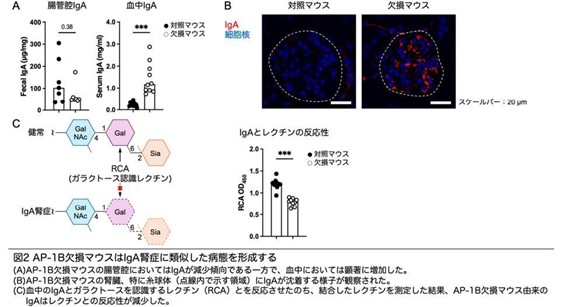
AP-1B欠損マウスでは、腸管腔におけるIgAは減少傾向である一方で、血中においては顕著に増加していました。ここから、IgAが腸管から血流を経て腸管外に影響を及ぼすのではないかと想定。そして、全身組織の解析をした結果、腎臓の糸球体にIgAが沈着していることを見出しました。
糸球体ではIgAとともにIgGと補体因子C3も検出されました。これはIgAがただ沈着しているのではなく、免疫複合体を形成していることを示しています。さらには、AP-1B欠損マウスの血中IgAでは、IgAの正常な立体構造形成に必要なガラクトース修飾の減少が認められ、これにより免疫複合体の形成が引き起こされたと考えられました。これらの異常は、IgA腎症で認められる特徴に似ているといいます。
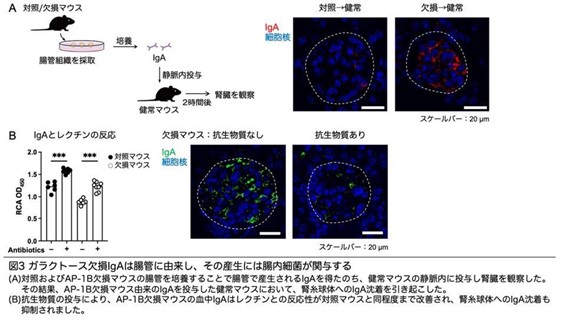
最後に、ガラクトース欠損IgAの産生源や原因の解明するため、腸管に存在する抗体産生細胞を分取し、ガラクトース転移酵素ファミリー遺伝子の発現量を測定しました。その結果、AP-1B欠損マウスでは複数のガラクトース修飾酵素の遺伝子発現が低下していました。また、AP-1B欠損マウスの腸管組織を培養後、上清中のIgAを回収して、健常マウスの静脈内に投与した結果、AP-1B欠損マウスの腸管由来IgAの投与によって、腎糸球体へのIgA沈着が確認されました。さらに、AP-1B欠損マウスでは腸上皮バリア機能の低下による腸内細菌叢の構成異常(ディスバイオ―シス)が認められました。抗生物質の投与により腸内細菌を除去すると、IgAのガラクトース修飾が改善し、腎糸球体へのIgA沈着も抑制することが明らかになりました。
以上の研究成果より、リーキーガットがIgA腎症の発症原因となることが明らかになりました。今後、研究のさらなる発展により、IgA腎症の発症機序の全容解明に、また腸管をターゲットにしたIgA腎症の治療法の開発に貢献できると考えられます。











