後天性血友病Aを対象にヘムライブラを皮下投与した国内第III相AGEHA試験の最終結果が国際血栓止血学会で発表される
中外製薬株式会社は6月26日、抗血液凝固第IXa/X因子ヒト化二重特異性モノクローナル抗体 血液凝固第VIII因子機能代替製剤へムライブラ(一般名:エミシズマブ(遺伝子組換え))について、免疫抑制療法不適格例を含む後天性血友病Aを対象に実施した国内第III相臨床試験「AGEHA試験」の最終解析結果が、カナダ・モントリオールで開催された第31回国際血栓止血学会(ISTH:International Society on Thrombosis and Haemostasis)において、発表されたと公表しました。
後天性血友病Aは、血液凝固第VIII因子に対する阻害物質(インヒビター)が後天的に出現した結果、突発的な皮下出血や筋肉内出血などの症状が現れる疾患です。時に重篤な出血を引き起こすこともあります。治療は、インヒビターを消失させるための免疫抑制療法と、出血症状を改善させるための治療があります。
AGEHA試験は、後天性血友病Aの患者さんを対象に、ヘムライブラを皮下投与した際の安全性、有効性、薬物動態および薬力学を検討する、2つのコホートからなる多施設共同単群国内第III相臨床試験です。登録患者さんの詳細は、コホート1では、登録時点で免疫抑制療法を開始予定または実施中の後天性血友病Aの成人12例と、コホート2では登録時点で免疫抑制療法不適格と判定された後天性血友病Aの成人2例です。試験参加者は、ヘムライブラを1日目に6mg/kg(体重)、2日目に3mg/kg(体重)を皮下投与、8日目から1回1.5mg/kg(体重)を1週間の間隔で皮下投与されました。また、ヘムライブラの投与終了基準として、第VIII因子活性が50IU/dL超であることが確認され、かつ直近の治療を要した出血に対する最後の血液凝固因子製剤投与から72時間超が経過していた場合と設定されていました。
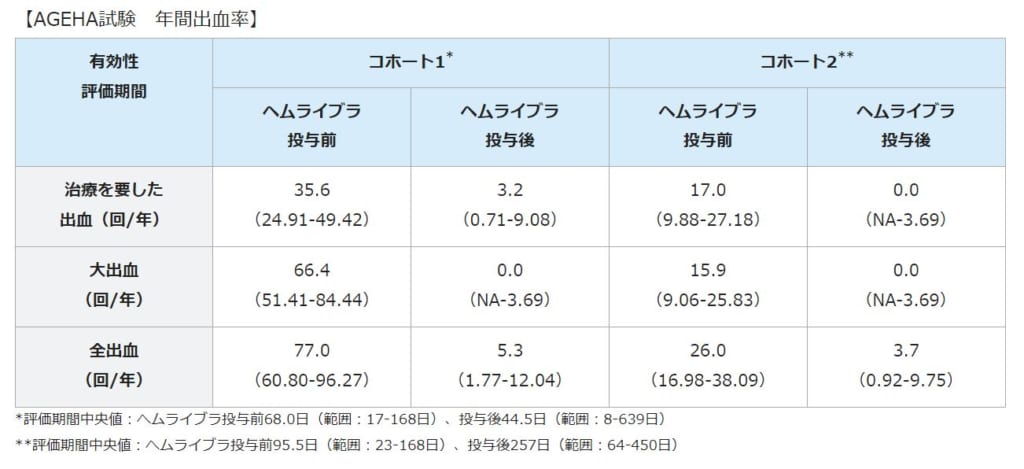
今回の最終解析の結果、コホート1の75%(9/12人)とコホート2の100%(2/2人)でヘムライブラ投与期間中に治療を要した出血の発現は認められませんでした。また、詳細な結果は下記の通りです。
代表取締役社長CEOの奥田修氏は「後天性血友病Aは、指定難病の自己免疫疾患として、出血コントロールが可能な治療オプションが長らく限られていました。今回新たに発表したヘムライブラのデータは、長期投与時の出血コントロールの持続と、標準治療である免疫抑制療法が使用できない患者さんに対する出血リスクの低減を示唆しました。出血を有効にコントロールできる治療オプションとして患者さん、介護者の方々、医療関係者に本剤によるベネフィットを提供できるよう、引き続きヘムライブラのデータ構築と適正使用を推進してまいります」と述べています。











