レノックス・ガストー症候群に伴うてんかん発作の治療薬としてフィンテプラの適応追加承認を申請
ユーシービージャパン株式会社は6月27日、レノックス・ガストー症候群(LGS)に伴うてんかん発作の治療薬として、フィンテプラ内用液2.2mg/mL(一般名:フェンフルラミン塩酸塩)の適応追加承認申請を、厚生労働省に行ったと発表しました。
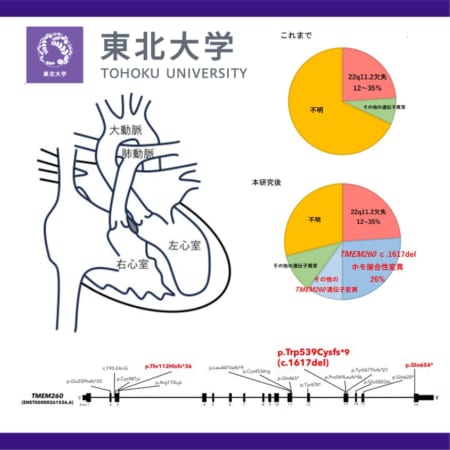
レノックス・ガストー症候群は、幼児期から小児期に発症する難治性てんかんで、多様な薬剤抵抗性のてんかん発作が起こり、精神発達障害、運動障害等を呈する重篤な疾患です。中でも、全般硬直代間発作(GTC)は、てんかんにおける突然死の主要リスクファクターでもあります。現在、指定難病に登録されていて、日本における患者数は約4,300人と推定されています。
フィンテプラ内用液2.2mg/mLは、セロトニン放出作用、セロトニン受容体刺激作用およびシグマ-1受容体への作用により発作を抑制すると考えられています。現在、国内ではドラベ症候群およびレノックス・ガストー症候群に対する希少疾病用医薬品に指定されています。また、米国および欧州では、ドラベ症候群およびレノックス・ガストー症候群に伴うてんかん発作の治療薬として承認されています。
今回の申請は、フェンフルラミン塩酸塩による有効性および安全性を検討した国際共同第Ⅲ相試験「1601試験」等の成績に基づいています。同試験には日本人33名も参加しています。同試験の結果、プラセボ群と比較して、転倒発作頻度の有意なベースラインからの減少が認められ、主要評価を達成しました。
ユーシービージャパン株式会社は「フィンテプラが、アンメットメディカルニーズの高い希少疾患であるLGSと共に生きる患者さんの新たな治療選択肢となることを期待しており、本剤をいち早くお届けするために、承認取得に向けて取り組んでまいります。」と述べています。