【欧州】ウパダシチニブ、中等症から重症のクローン病を有する成人患者さんの治療薬としての承認をCHMPが推奨
米アッヴィ社は2月27日、ウパダシチニブ45mg(寛解導入療法時の用量)、ならびに15mgおよび30mg(維持療法時の用量)について、既存治療または生物学的製剤で効果不十分、効果減弱または不耐容であった中等症から重症の活動性クローン病(CD)を有する成人患者さんの治療薬としての承認を、欧州医薬品庁(EMA)の欧州医薬品委員会(CHMP)が推奨したと発表しました。
アッヴィ社のsenior vice president, development, regulatory affairs兼chief medical officerであるRoopal Thakkar, M.D.はプレスリリースにて「今回、ウパダシチニブについて、クローン病治療薬としてCHMPによる承認推奨を得たことは、この疾患に苦しむ患者さんの生活に変化をもたらしうる、JAK阻害薬では初の1日1回経口薬の提供の実現に向けた、大きな一歩です。炎症性腸疾患の患者さんに向けて、幅広い治療選択肢を提供できるよう、引き続き研究開発に真摯に取り組んでまいります」と述べています。
クローン病治療薬としてのウパダシチニブの承認申請は、2つの寛解導入療法試験(U-EXCEEDおよびU-EXCEL試験)、ならびに1つの維持療法試験(U-ENDURE試験)から得られたデータに基づくものです。これらの試験において、ウパダシチニブ群で有意に高い割合の患者さんが、主要評価項目であるSF/APに基づく臨床的寛解および内視鏡的改善が見られました。
クローン病におけるウパダシチニブの安全性プロファイルは、これまでに確認されているウパダシチニブの安全性プロファイルとおおむね一致していました。重篤な感染症などを含む有害事象の発生率は、ウパダシチニブ群、プラセボ群共に同様であり、悪性腫瘍、主要心血管イベント、静脈血栓塞栓性イベントおよび消化管穿孔の報告は低頻度でした。
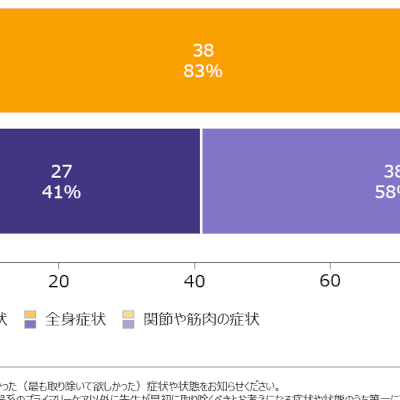
マウント・サイナイ・アイカーン医科大学内科学教授、炎症性腸疾患センター所長(professor of medicine and director of Inflammatory Bowel Disease Center, Icahn School of Medicine,Mount Sinai)であり、治験責任医師であるJean-Frédéric Colombel M.D.はプレスリリースにて「クローン病が与える影響は腸だけに留まりません。疲労などの全身症状や腸症状を引き起こし、社会的・情緒的機能にも影響を及ぼすと言われています。臨床的寛解や内視鏡的改善などの重要な評価項目を達成する治療選択肢は、この疾患の困難な症状の管理、そしてQOL(生活の質)に関わる健康関連の転帰に変化をもたらす可能性があります。ウパダシチニブは、コントロール不良の中等症から重症のクローン病の患者さんにとって有望な治療選択肢となりえます。ECの最終決定が待ち遠しいです」と述べています。