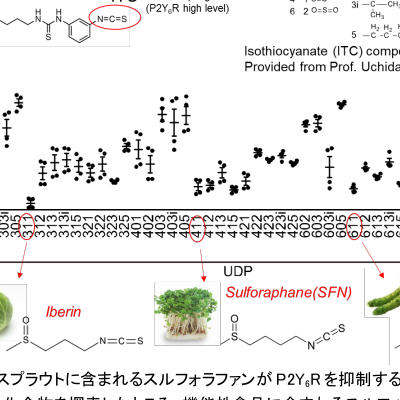
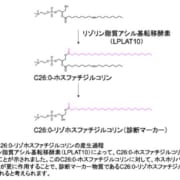
セルメチニブ、FDAにおいて神経線維腫症I型(NF1)の画期的治療薬として指定
4月8日にアストラゼネカ株式会社、
メルク・アンド・カンパニー は、MEK1/2阻害剤(セルメチニブ)が、
米国食品医薬品局(FDA)より 神経線維腫症I型(別名:レックリングハウゼン病)に対する画期的治療薬に指名されたとの発表がありました。
今回の指定は、神経線維腫症に関連する進行・手術不能な叢状神経線維腫(以下、PNs)を有する3歳以上の神経線維腫症I型(以下、NF1)患者さんを対象としているのとのこと。
指定に至る経緯は、3歳以上のNF1に関連する進行・手術不能なPNsを有する小児患者を対象にセルメチニブ単剤の経口投与を行った、第2相SPRINT試験のデータに基づいたものであり、同試験結果は、米国国立がん研究所(NCI)が、2018年の米国臨床腫瘍学会年次総会において発表済みとのことだ。
現在、セルメチニブの単独投与及び他の治療との併用で評価する試験が進行中です。
※セルメチニブは日本では未承認薬です。
SPRINT試験について
SPRINT試験は、米国国立がん研究所(NCI)の米国癌治療効果判定プログラム(CTEP)によって行われている第I/II相試験です。第I相試験は、最適な第II相投与レジメンを特定する目的でデザインされ、その結果はNew England Journal of Medicineに掲載されています
アストラゼネカ株式会社 プレスルーム
神経線維腫症Ⅰ型(指定難病34)
神経線維腫症I型(NF1)はカフェ・オ・レ斑,神経線維腫という皮膚の病変を特徴とし,そのほか骨,眼,神経系などに様々な病変を生じる遺伝性の病気です。NF1は1882年にドイツの病理学者レックリングハウゼン氏によりはじめて報告されたため,レックリングハウゼン病とも呼ばれています。神経線維腫症II型*1とは全く別の病気で,原因や症状は異なっています。
難病情報センター
神経線維腫症に関するニュース・イベント情報はこちら
この記事に利益相反はありません。