紀伊半島の神経難病「牟婁病」のグリア細胞に関わる病態を解明、iPS細胞創薬に繋がる可能性
慶應義塾大学と三重大学は5月30日、紀伊半島に多発する筋萎縮性側索硬化症/パーキンソン認知症複合(牟婁(むろ)病)患者さんのiPS細胞モデルを用いて、病気に重要な役割を果たすと考えられているアストロサイトを作製して、CHCHD2というミトコンドリア機能に重要な遺伝子およびタンパク質が、著明に低下していることを明らかにしたと発表しました。さらに、アストロサイトの神経保護機能が低下していること、機能を回復する手法、そして実際の患者脳脊髄内アストロサイトでもCHCHD2の異常をきたしていることを突き止めました。
太平洋熊野灘に面する紀伊半島の南岸一帯は、江戸時代まで紀伊国の牟婁と呼ばれていました。この地域を流れる古座川地域には、「古座の足萎え病」の伝承があり、明治末には三浦謹之助氏によって、紀伊半島南岸に筋萎縮性側索硬化症(ALS)が多発することが指摘されていました。また、和歌山県立医科大学は、「古座の足萎え病」が筋萎縮性側索硬化症(ALS)であること、紀伊半島南岸にグアム島や西ニューギニアに並ぶ筋萎縮性側索硬化症(ALS)高集積地があることを突き止めました。
その後の研究により、紀伊半島集積地の筋萎縮性側索硬化症(紀伊ALS)は神経病理学的には中枢神経系にAlzheimer神経原線維変化(NFT)が多発し、他多発地筋萎縮性側索硬化症(ALS)と同質の疾患と考えられていました。
1980年代には筋萎縮性側索硬化症(ALS)の発生が激減したと言われていましたが、1990年には持続して多発していることがわかり、さらに、パーキンソン・認知症複合(PDC)が併せて多発していることを見出しました。
牟婁病多発の原因因に関しては、環境因、遺伝素因ともに解明されていません。
近年、慶應義塾大学の岡野氏らのグループが、原因となる遺伝子や病態背景が確定していない疾患に対する病態解析プラットフォームおよびiPS細胞創薬という新たな創薬様式を確立しました。
今回、研究グループは、上記の研究成果を踏まえた上で、5名の牟婁病の患者さんの血液細胞から患者iPS細胞を樹立。さらに、牟婁病の病態として重要なアストロサイトを、患者iPS細胞から独自の技術を用いて分化誘導しました。

その結果、患者アストロサイトは、活性型アストロサイトの形態をとる傾向にあり、細胞自体に何らかの異常があることが推察されました。そこから、細胞のRNA-seq解析を行ったところ、ミトコンドリアという細胞を維持するための細胞内小器官の機能に非常に重要なタンパク質である「CHCHD2」をコードする遺伝子の発現が著明に低下していることが判明。さらに、遺伝子導入によりCHCHD2の発現を回復することで、部分的に患者アストロサイトの機能を改善しました。また、ミトコンドリア機能を改善し、患者アストロサイトの機能回復を誘導する低分子化合物を見出す事にも成功しました。
最後に、亡くなられた患者さんの剖検脳・脊髄を調べた結果、iPS細胞由来アストロサイトでの変化と同様に、CHCHD2タンパク質が、大脳皮質運動野および脊髄前角(いずれも筋萎縮性側索硬化症(ALS)や牟婁病で障害を受ける脳領域)にあるアストロサイトで減少していることも明らかになりました。
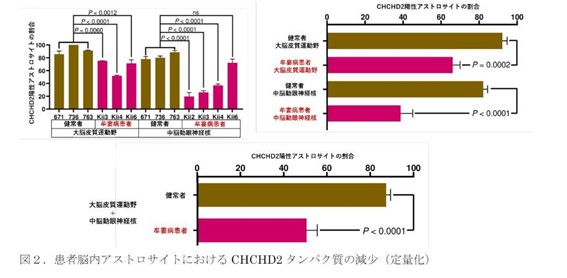
以上の研究成果より、患者さんの脳脊髄内で起きている病態を、患者iPS細胞由来アストロサイトを用いて再現できることがわかりました。このことは、疾患特異的iPS細胞が、牟婁病のような明らかな遺伝子異常を含む原因がわかっていない疾患の病態を研究する際にも、有効なモデルであることを示しています。さらに、iPS細胞由来アストロサイトで効果を認めたミトコンドリアに対する治療手法は、今後のiPS細胞創薬に繋がる重要な手がかりであると考えられます。

研究グループはプレスリリースにて、「今後は、アストロサイトのみではなく、Kii ALS/PDCで障害を受ける運動ニューロンや大脳皮質ニューロンなど、様々な細胞種に関しても病態解析や薬剤アプローチを行い、CHCHD2が減少している機序の解明や病気の改善につながる創薬に繋げていきます」と述べています。
なお、同研究の成果は、科学誌「Acta Neuropathologica」オンライン版に5月16日付で掲載されました。