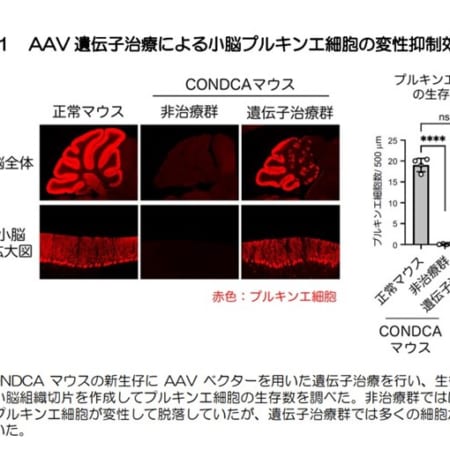
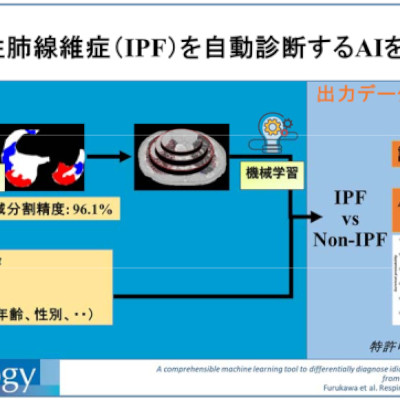
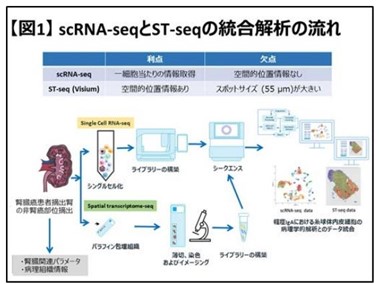
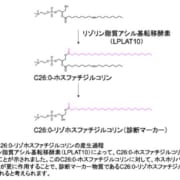
ウステキヌマブのバイオ後続品、第1相試験の成績と臨床第3相試験の開始を発表
Meiji Seikaファルマ株式会社は5月21日、韓国の東亞ソシオホールディングス株式会社と共同開発中のバイオ後続品「DMB-3115」について、第1相試験の成績と尋常性乾癬患者さんを対象とする第3相試験の開始を発表しました。
Meiji Seikaファルマらが開発を進めるDMB-3115は、尋常性乾癬、クローン病(CD)や潰瘍性大腸炎(UC)などの治療に用いられる抗体医薬品「ウステキヌマブ(遺伝子組換え)」のバイオ後続品。同社は2011年9月に東亞ソシオホールディングスと締結したバイオ後続品に関する戦略的包括提携に基づき、同剤の開発を共同で進めています。
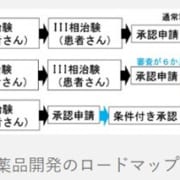
欧州で健康成人296人を対象として実施した臨床第1相試験では、DMB-3115(皮下投与)の安全性および薬物動態学的特性を欧州・米国で使用されている先行バイオ医薬品と比較。その結果、DMB-3115と先行バイオ医薬品との生物学的同等性が検証されたそうです。また、忍容性も良好で、先行品との違いなど安全性上の懸念は認められなかったとしています。
また、尋常性乾癬患者さんを対象に国際共同治験として欧米で開始した臨床第3相試験は、DMB-3115と先行バイオ医薬品の有効性・薬物動態・免疫原性の同等性および安全性の確認を目的に、無作為化・二重盲検比較試験として実施されています。
Meiji Seikaファルマはプレスリリースにて、「DMB-3115をはじめ、安全かつ有効なバイオ後続品を早期に上市するとともに、バイオ医薬品の普及ならびに医療と社会に貢献することを目指します」と述べています。