X連鎖性ミオチュブラーミオパチー(XLMTM)の新たな病態を解明
京都大学は8月25日、X連鎖性ミオチュブラーミオパチー(XLMTM)患者由来のiPS細胞を⽤いることで、細胞内の様々なシグナルを伝える役割を持つ⼩器官「リソソーム」が細胞の隅に異常に集積する現象を発⾒したと発表しました。さらに、この異常な集積が細胞成⻑のアクセル役である「mTORC1」シグナルを活性化させ、正常な筋⾁の成熟を妨げていることを明らかにしました。
X連鎖性ミオチュブラーミオパチー(XLMTM)は、生まれつき全身の著しい筋力低下を引き起こす、重篤な先天性の筋疾患です。現在、遺伝子治療などの先進的な治療法の開発も進められていますが、根本的な治療法はまだ確立されていません。しかし、この度、京都大学の研究グループが、これまで不明であったX連鎖性ミオチュブラーミオパチー(XLMTM)の病態メカニズムを解明し、新たな治療戦略の可能性を示しました。
今回、研究グループは、患者さん由来のiPS細胞とゲノム編集技術を⽤いて、病気の原因遺伝⼦(MTM1)のみが異なる疾患モデルiPS細胞と、それを修復した健常なiPS細胞を作製。これらのiPS細胞から、筋⾁の元となる細胞を効率的に分化させる系を⽤いて、病態を詳細に解析しました。
その結果、X連鎖性ミオチュブラーミオパチー(XLMTM)の筋細胞では、細胞内の不要な物質を分解する「リソソーム」と呼ばれる小器官が、本来あるべき核の周辺から細胞の隅へと異常に集積し、留まってしまう現象を発見しました。さらに、このリソソームの異常な局在が、細胞の成長や増殖を制御する「アクセル」のようなシグナル伝達経路である「mTORC1」を過剰に活性化させてしまうことを明らかにしました。筋肉が正常に分化・成熟するためには、このmTORC1の適切な調整が不可欠であるため、過剰な活性化が正常な筋分化を妨げていたのです。
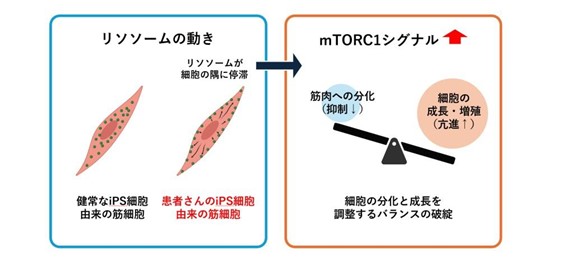
薬剤(ラパマイシン)を用いてこの過剰に活性化したmTORC1の働きを抑えると、Mtm1遺伝子を欠損させたマウス筋芽細胞で見られる分化の障害が改善することも確認されました。これらの結果は、「リソソームの異常集積→mTORC1の過剰活性化→筋分化の障害」という一連の連鎖反応が、X連鎖性ミオチュブラーミオパチー(XLMTM)の病態の中心的なメカニズムのひとつであることを示しています。
以上の研究成果より、X連鎖性ミオチュブラーミオパチー(XLMTM)において「リソソームの動態異常」と「mTORC1シグナルの過剰活性化」という、新たな病態メカニズムが解明されました。これは、遺伝子治療とは全く異なるアプローチである「mTORC1シグナル伝達の制御」を創薬ターゲットとする可能性を示すものであり、今後のX連鎖性ミオチュブラーミオパチー(XLMTM)治療に新たな道を開くことが期待されます。
なお、同研究の成果は、国際学術誌「Brain」オンライン版に7月29日付で掲載されました。











