トランスサイレチン型心アミロイドーシスに対するアムヴトラ、医薬品製造販売承認事項一部変更を申請
Alnylam Japan株式会社(アルナイラム社)は11月11日、「アムヴトラ(一般名:ブトリシランナトリウム)」について、トランスサイレチン型心アミロイドーシスを対象とした治療薬として医薬品製造販売承認事項一部変更申請をしたと発表しました。
トランスサイレチン型心アミロイドーシスは、アミロイドというタンパク質が臓器や心臓に沈着する疾患です。急速に進行し、身体的に衰弱させ、死に至ることも多いです。指定難病である全身性アミロイドーシス(指定難病28)の1つです。
アムヴトラは現在、日本を含む15か国以上で承認・販売されているトランスサイレチン型家族性アミロイドポリニューロパチーの治療薬です。日本では、トランスサイレチン型心アミロイドーシス(野生型及び変異型)に対して2024年8月28日に希少疾病用医薬品に指定され、優先審査の対象となっています。海外では、米国、EUにおいて、トランスサイレチン型心アミロイドーシスの治療に対する適応追加のための一部変更申請を提出しています。
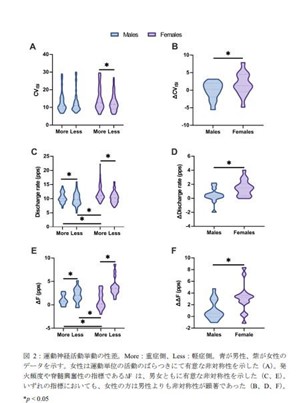
今回の申請は、第III相HELIOS-B試験の肯定的な結果に基づくものです。同試験は、トランスサイレチン型心アミロイドーシス(遺伝性または野生型)と診断された655名の成人患者さんが登録された、第III相、無作為化、二重盲検、プラセボ対照、多施設共同の国際共同試験です。全死因死亡及び再発性心血管関連イベントの主要複合評価項目の減少というアムヴトラの有効性及び安全性を評価するように計画されました。
アルナイラム社代表取締役社長の岡田裕氏はプレスリリースにて、「トランスサイレチン型心アミロイドーシスは、症状の進行が早く、死に至るケースもある疾患です。心不全の原因としても認知されるようになっており、多くのアンメットニーズが存在します。アムヴトラの適応追加が新たな治療選択肢となり、患者さんに貢献できるよう、承認取得に向け引き続き尽力してまいります」と述べています。
なお、同試験のデータは、英国ロンドンで8月30日から9月2日まで開催された欧州心臓病学会(ESC Congress 2024)のHot Lineセッションで発表されました。また、「The New England Journal of Medicine」に掲載されました。