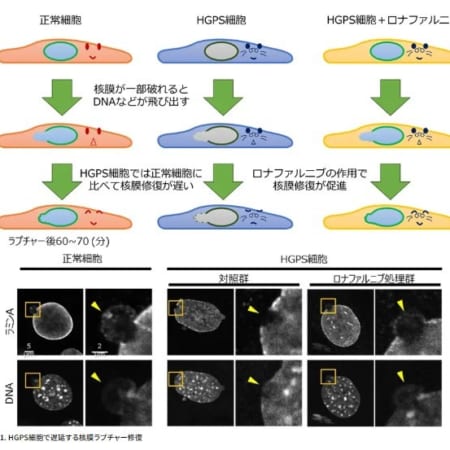
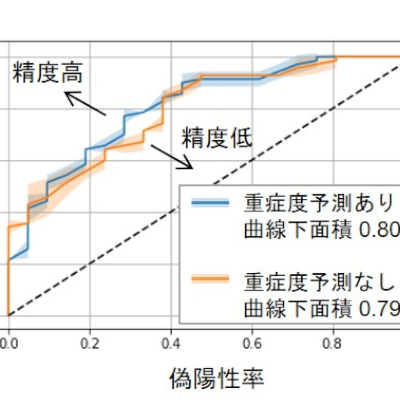
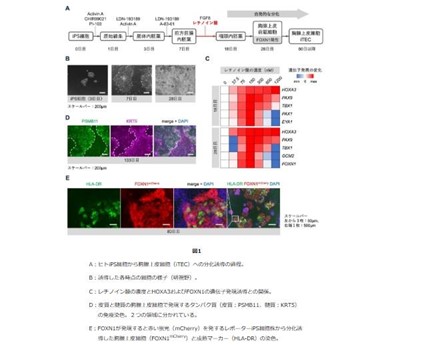
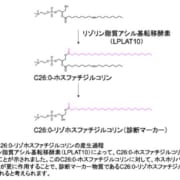
【米】パーキンソン病治療薬ND0612の米国承認申請に関する審査完了報告通知を受領
田辺三菱製薬株式会社は10月23日、同社子会社のイスラエル・ニューロダーム社が開発を進めている、運動症状の日内変動を有するパーキンソン病を対象とした治療薬「ND0612」について、米国食品医薬品局(FDA)より審査完了報告通知(Complete Response Letter)を受領したと発表しました。
パーキンソン病(指定難病6)は、脳の異常により、振戦(ふるえ)、動作緩慢、筋強剛(筋固縮)、姿勢保持障害(転びやすいこと)などの症状が現れる疾患です。
ND0612は、レボドパとカルビドパを液剤にし、注入ポンプを用いて患者さんに24時間持続的に皮下投与する治療薬です。パーキンソン病に対する従来の経口のレボドパ/カルビドパ治療では、レボドパの血中濃度の変動が大きくあり、安定した臨床効果を得ることが難しいという、アンメット・メディカル・ニーズがあります。ND0612は、24時間持続皮下投与を行うことで、レボドパの血中濃度を持続的に安定させ、薬物動態プロファイルを改善し、運動症状の日内変動を減少させることが期待されています。
田辺三菱製薬はプレスリリースにて、「今回、FDAからは、製剤の製造所および非臨床情報に対して指摘がありました。これを受け、引き続きFDAと緊密に連携しながら、再申請をめざし、研究開発の重点領域に定める中枢神経領域において、神経変性疾患に向きあうすべての人に、新しい治療の選択肢を届けるため取り組んでいきます」と述べています。