家族性ALSが有する遺伝的背景が血液脳関門の異常につながる、ALSの進行にBBB破綻が関与する可能性
山口大学の研究チームは12月13日、慶應義塾大学、東北大学大学院医学系研究科の研究グループとの共同研究で家族性筋萎縮性側索硬化症(家族性ALS)患者由来のiPS 細胞を使った新しいヒト血液脳関門(Blood-brain barrier:BBB) 実験モデルを確立し、このバリア機能が家族性筋萎縮性側索硬化症(家族性ALS)患者さんのもつ遺伝的背景から影響を受ける可能性を明らかにしたと発表しました。
筋萎縮性側索硬化症(指定難病2、ALS)は、手足・のど・舌の筋肉や呼吸に必要な筋肉が徐々に痩せて力がなくなっていく疾患です。近年の動物モデルを用いた研究によって、筋萎縮性側索硬化症(ALS)の進行には脳を守るバリアである血液脳関門(BBB)の異常が関与していることが分かっています。
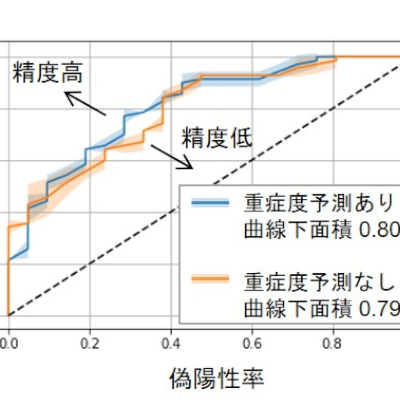
今回、研究グループは、家族性筋萎縮性側索硬化症(家族性ALS)患者さん(TAR DNA Binding Protein:TARDBP変異保有)から得られたiPS細胞を用いて脳微小血管内皮細胞(Brain microvascular endothelial cell : BMEC)様細胞を作製し、BMEC の異常がどのように筋萎縮性側索硬化症(ALS)の進行に関わっているかを調べました。その結果、患者由来の細胞ではバリア機能に異常があり、外部からの有害物質が脳に侵入するリスクが高まることが確認されました。このバリア機能の異常は、炎症や神経細胞の損傷とは独立して起こっているといいます。
さらに、Wnt/β-カテニン経路を化合物によって活性化することで、筋萎縮性側索硬化症(ALS)患者由来 BMEC のタイトジャンクション(細胞間の緊密な結合)の破綻や免疫細胞が脳に入り込む際に働く接着分子であるVCAM-1の発現亢進が回復し、バリア機能が改善されることが示されました。
以上の研究成果より、本モデルが筋萎縮性側索硬化症(ALS)患者さんにおけるバリア機能異常に対する治療薬の探索にも有用であることが示され、新たな治療法の開発につながることが期待されるといいます。
なお、同研究の成果は、「Frontiers in Cell and Developmental Biology」に8月15日付で掲載されました。