筋萎縮性側索硬化症(ALS)の病態メカニズムに重要な役割を果たす核膜と核膜孔の障害を発見
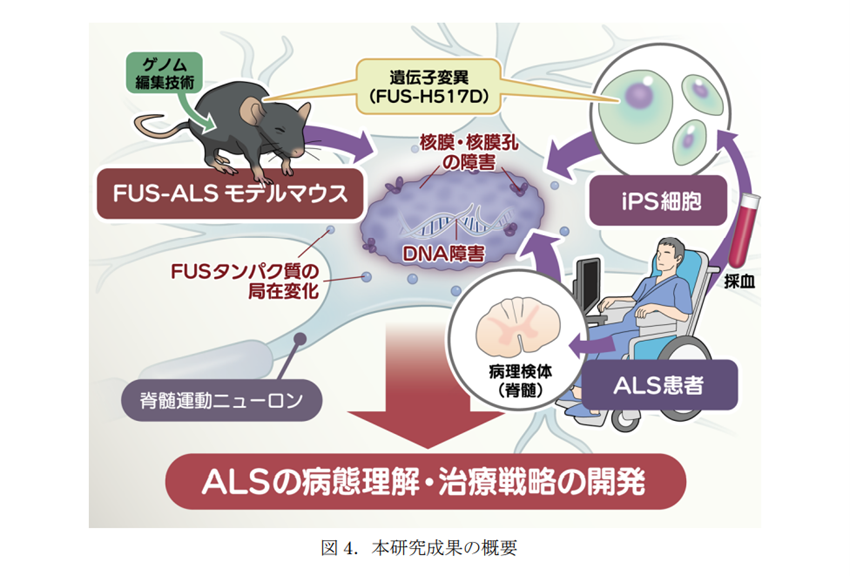
慶應義塾大学の研究グループは9月24日、筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis: ALS)の新規モデルマウスをゲノム編集技術「CRISPR-Cas9システム」を用いて作成することに成功したと発表しました。
筋萎縮性側索硬化症(指定難病2、ALS)は、手足・のど・舌の呼吸に必要な筋肉が徐々に痩せて力がなくなっていく疾患です。国内には、約9000人の患者さんがいると言われています。現在、日本では、リルゾールとエダラボンの2剤が治療薬として承認されており、今後メコバラミン筋注の承認が期待されますが、更なる治療薬の開発が望まれています。
核膜と核膜孔は、細胞において、非常に重要な役割を果たしています。核膜は、細胞の核を囲む二重膜構造で、細胞質から核を保護し、核内の DNA を外部の影響から守る役割を担っています。核膜は、細胞のDNA複製や転写、修復といった重要なプロセスを制御する場として機能しています。また、核膜は核の形状を維持するためにも重要で、核の構造を安定させる役割も果たしています。
今回、研究グループは、FUS 遺伝子の点変異を導入して作成したマウスモデルと、既に同グループが確立している同一の FUS-H517D 変異を持つ筋萎縮性側索硬化症(ALS)患者さんから樹立した iPS 細胞から分化誘導した運動ニューロンを比較・検討し、さらには、筋萎縮性側索硬化症(ALS)患者さんの死後組織(脊髄)を用いて、核膜・核膜孔への病態解明を行いました。
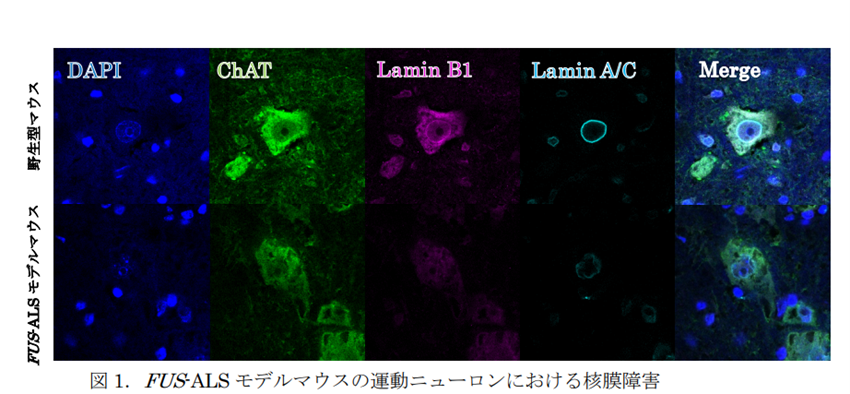
まず、高齢(18月齢)の野生型マウスと FUS-ALS モデルマウスにおける脊髄前角にある運動ニューロン(ChAT染色)における核膜の形態などを評価する目的で免疫染色を実施。FUS-ALS モデルマウスの運動ニューロンでは,核膜に相当する部分の輝度の低下や真円度の低下を認めました。
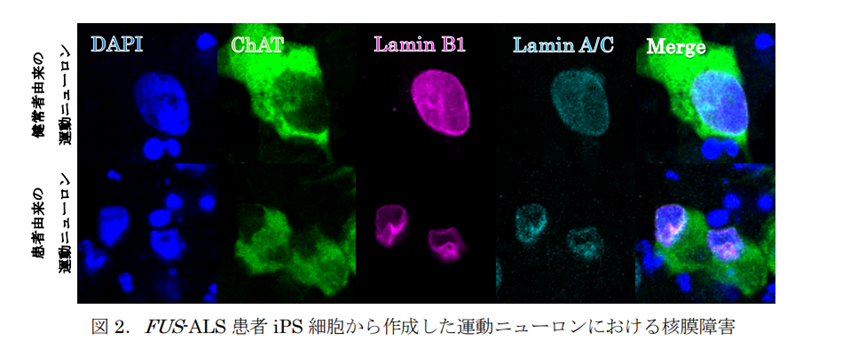
次に、マウスと同じ変異(FUS-H517D)を持つ筋萎縮性側索硬化症(ALS)患者由来の iPS 細胞から分化誘導した脊髄運動ニューロンにおいても、免疫染色での核膜(Lamin B1, Lamin A/C)の評価を行った結果、FUS-ALS患者由来のiPS細胞から分化した脊髄運動ニューロンでも核膜障害を示唆する所見を認めました。
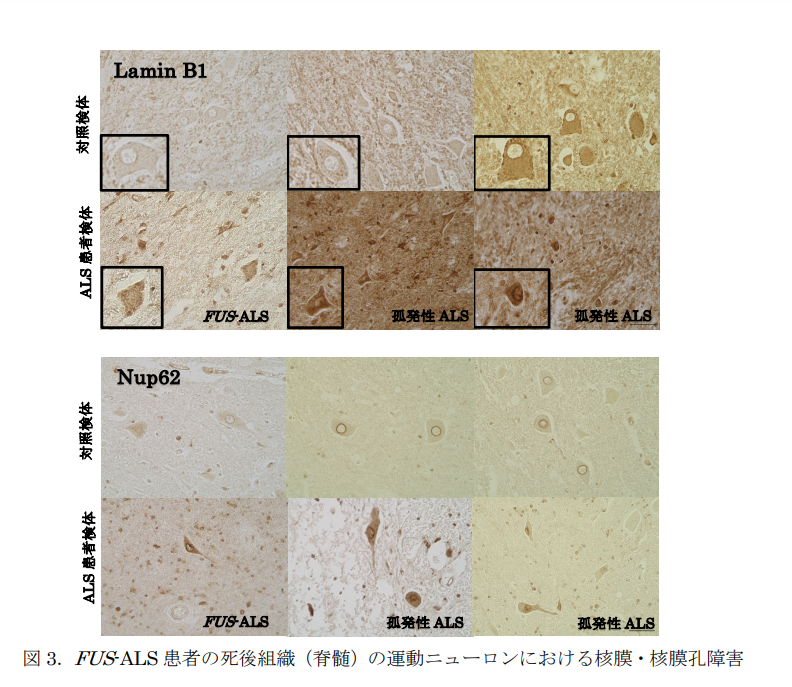
最後に、筋萎縮性側索硬化症(ALS)患者さんの死後組織(脊髄)においても、核膜と核膜孔に障害があることを確認しました。
以上の研究成果より、筋萎縮性側索硬化症(ALS)で見られる遺伝子異常を再現したゲノム編集マウスが、加齢に伴い運動機能障害を示し、そこで観察された核膜および核膜孔の障害が 筋萎縮性側索硬化症(ALS)の決定的な病態メカニズムであり、新規治療ターゲットであることが示されました。ゲノム編集マウス・iPS細胞と患者病理検体を組み合わせることで、筋萎縮性側索硬化症(ALS)の病態理解を深め、治療薬の開発に繋がることが期待されるといいます。
慶應義塾大学はプレスリリースにて、「患者iPS細胞を用いて ALS 治療薬候補としてロピニロール塩酸塩を同定しており(Morimoto S, et al. Cell Stem Cell 2023)、次の研究としてロピニロール塩酸塩による核膜障害抑制作用を検討して参ります」と述べています。
なお、同研究の成果は、国際学術誌「Brain」に9月24日付で掲載されました。
────────────────────────────────────────────────
【レアズからのお知らせ】
ALSの患者さん 臨床研究(インタビューまたはアンケート調査)のご案内
────────────────────────────────────────────────