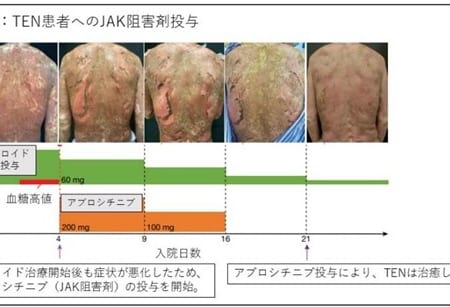
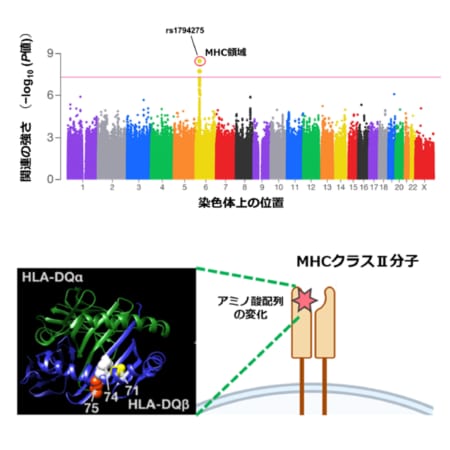
【欧州】中等症から重症の活動期潰瘍性大腸炎の成人患者さんの治療薬としてリサンキズマブが欧州医薬品委員会より肯定的見解を取得
米アッヴィ社は6月20日、リサンキズマブについて、既存治療または生物学的製剤で効果不十分、効果減弱または不耐容であった中等症から重症の活動期潰瘍性大腸炎を有する成人患者さんの治療薬として承認を推奨する肯定的見解を、欧州医薬品庁(EMA)の欧州医薬品委員会(CHMP)から得たと発表しました。
潰瘍性大腸炎(指定難病97)は、大腸の粘膜にびらんや潰瘍ができる炎症性疾患です。主な症状は、直腸出血、腹痛、血性下痢、しぶり腹、便意切迫および便失禁です。潰瘍性大腸炎の経過は患者さんによって異なり、は外科手術や生命を脅かす合併症の発症に至ることもあります。重い症状と予測不可能な経過は、患者さんにとって大きな負担となるため、生活に支障をきたすことがあると報告されています。
リサンキズマブは、インターロイキン-23(IL-23)のp19サブユニットに結合することによりIL-23を選択的にブロックするIL-23阻害薬です。用量については、寛解導入療法として1200mgを静脈内(IV)投与し、その後、個々の患者さんの症状に応じて維持療法として180mgまたは360mgを皮下(SC)投与することが推奨されています。欧州委員会の最終決定は2024年の第3四半期に予定されています。
欧州医薬品委員会(CHMP)による肯定的見解は、2つの第III相試験(INSPIRE寛解導入療法試験1およびCOMMAND維持療法試験2)で得られたデータに基づいたものです。
INSPIRE試験は、中等症から重症の活動期潰瘍性大腸炎を有する患者さんを対象とした試験で、リサンキズマブによる寛解導入療法(0週、4週および8週時に1200mgをIV投与)を評価しました。COMMAND試験は、INSPIRE試験で寛解導入療法が奏効した患者さんを対象とした試験で、52週間の維持療法としてリサンキズマブ180mgまたは360mgのSC投与群に無作為に割り付けました。両試験のいずれにおいても、リサンキズマブの安全性プロファイルは、さまざまな適応症を対象としたこれまでの試験全体でみられた安全性プロファイルとおおむね一致しており、新たな安全性のリスクは認められませんでした。
アッヴィ社の vice president兼global head of immunology clinical developmentであるKori
Wallace, M.D., Ph.D.はプレスリリースにて、「アッヴィでは、すべての活動において患者さんを中心に考え取り組んでいます。消化器領域で進行中の研究開発への取り組みを通じて、必要としている患者さんに新たな治療選択肢を提供すべく尽力しています。患者さんが長期的な治療目標を達成できるようになる可能性があるリサンキズマブの潰瘍性大腸炎に対する使用について、EMAの最終決定を心待ちにしています」と述べています。
なお、欧州連合では、潰瘍性大腸炎に対するリサンキズマブの使用は承認されておらず、その安全性および有効性については引き続き評価中です。