小胞体ストレスセンサーIRE1αがインフラマソーム機能に必須の役割を果たす、新規の炎症制御薬の開発に期待
和歌山県立医科大学は4月11日、マウスマクロファージの解析により、小胞体ストレスセンサーIRE1αがインフラマソーム機能に必須の役割を果たすという、炎症性サイトカイン産生を制御する新規の分子基盤を明らかにしたと発表しました。
マクロファージは病原体を貪食すると共に、様々な炎症性サイトカインを産生し炎症反応を引き起こします。マクロファージが産生する代表的な炎症性サイトカインであるインターロイキン-1β(intrerleukin-1β: IL-1b)は、病原体センサーであるToll様受容体などの刺激によりIL-1β前駆体遺伝子の発現が亢進し、IL-1β前駆体タンパク質として産生されます。
しかし、このIL-1β前駆体は炎症誘導活性を持っていない不活性型であり、インフラマソームにより切断されて、はじめて活性型のIL-1bとして炎症誘導活性を発揮できるようになります。インフラマソーム機能が過剰になると、自己炎症性疾患・痛風・動脈硬化・糖尿病などの様々な慢性炎症性疾患の発症や病態の憎悪に繋がることがわかっています。
一方、その分子細胞基盤に関しては明らかになっていませんでした。
これまで、研究グループは、コレラ菌由来の毒素、コレラ毒素の免疫増強(免疫アジュバント)機能に着目し、その作用機構にインフラマソームが関与することを明らかにしました。しかし、コレラ毒素がインフラマソームを活性化させる要因は不明でした。
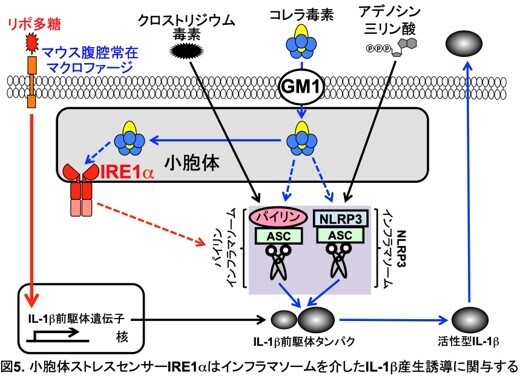
今回、研究グループは、これまでの研究を進め、腹腔マクロファージにおいて、コレラ毒素がGM1依存的に小胞体に侵入、蓄積し、小胞体ストレス応答を誘導すること、そして小胞体ストレスセンサーIRE1αがNLRP3インフラマソームやパイリンインフラマソームの刺激によるIL-1b産生誘導に必要であることを明らかにしました。
初めに、リポ多糖で刺激した腹腔マクロファージにおいて、コレラ毒素により誘導される遺伝子群の網羅的解析(RNAシークエンス)をおこないました。その結果、コレラ毒素の刺激で2倍以上発現が上昇する遺伝子が853個見られました。この遺伝子の中には、胞体ストレス応答により誘導される遺伝子が含まれていたことから、コレラ毒素が小胞体ストレス応答を誘導することが明らかになりました。

次に、小胞体ストレスセンサーPERKとIRE1αの阻害剤を用いて、どちらがIL-1b産生誘導に関与するかを検討しました。その結果、コレラ毒素によるIL-1b産生誘導は、PERK阻害剤の添加により影響を受けませんでしたが、IRE1α阻害剤の添加により、顕著に阻害されました。

さらに、マクロファージ特異的にIRE1αを欠損するマウスを用いて、生体内でのIRE1αの役割を明らかにしました。そして、IRE1α欠損腹腔マクロファージを解析したところ、コレラ毒素によるIL-1b産生誘導が障害されていることがわかりました。このことから、コレラ毒素で刺激された腹腔マクロファージにおける小胞体ストレス応答の誘導にはIRE1αが必須であることが明らかになりました。
IRE1α欠損腹腔マクロファージを用いて、NLRP3インフラマソームの活性化因子アデノシン三リン酸、パイリンインフラマソームの活性化因子クロストリジウム毒素それぞれのIL-1b産生誘導能を解析した結果、アデノシン三リン酸、クロストリジウム毒素いずれのIL-1b産生誘導能も障害されることが明らかになりました。このことから、小胞体ストレスセンサーIRE1αは、NLRP3、パイリン両方のインフラマソームの活性化に関与していると考えられます。
今回の研究で着目したマウス腹腔常在マクロファージは、生物種を超えて保存されており、ヒトの腹腔にも対応するマクロファージが常在しています。今回の研究成果より、このマクロファージからの炎症性サイトカインの産生に小胞体ストレスセンサーが関与するという新規の分子基盤が明らかになり、様々な慢性炎症性疾患や自己炎症性疾患の病態解明が進み、新規の炎症制御薬の開発に繋がることが期待されるといいます。
なお、同研究の成果は、国際学術誌「Cell Reports」オンライン版に3月22日付で掲載されました。











