抗CD38モノクローナル抗体mezagitamab、一次性免疫性血小板減少症を対象とした臨床第2相試験において良好な結果を達成
武田薬品工業株式会社は3月13日、持続性もしくは慢性の一次性免疫性血小板減少症(特発性血小板減少性紫斑病;ITP)の患者さんを対象としたmezagitamab(TAK-079)の安全性、忍容性および有効性を評価する臨床第2相、無作為化、二重盲検、プラセボ対照試験の良好なトップライン結果が得られたと発表しました。
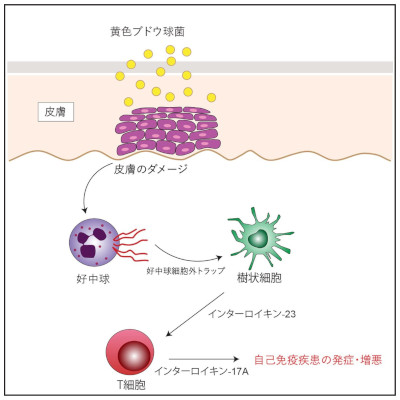
一次性免疫性血小板減少症は、IgGが介在する希少な自己免疫疾患で、出血防止や止血を担う血液細胞である血小板が減少することで発生する疾患です。血小板の加速的な破壊により、出血のリスクが高まり、疲労や生活の質(QOL)の低下などに繋がり、重症化すると生命が脅かされる場合もあります。一次性免疫性血小板減少症を適応とした新薬の承認を取得する場合は、持続的に血小板数を50,000/μL以上に維持する必要があります。患者さんの約20%は、第1選択薬および第2選択薬による治療を受けても血小板数が50,000/μL以上に達しないため、患者さんへの負担が大きいことから、忍容性の高い治療薬の開発が期待されています。
mezagitamabは、CD38発現細胞(形質芽細胞、形質細胞、ナチュラルキラー細胞を含む)に高い親和性を有する完全ヒト免疫グロブリンIgG1モノクローナル抗体(mAb)であり、CD38発現細胞を減少させることができます。mezagitamabで治療を行うことで、速やかにかつ持続的な血小板反応を発現し、血小板数を正常な機能が得られるレベルまで速やかに回復させることが期待できます。米国においては、米国食品医薬品局(FDA)よりオーファンドラッグ(希少疾病用医薬品)指定を取得し、同プログラムはファストトラック(優先審査)の対象とされています。
TAK-079-1004試験は、慢性(発症後1年以上)もしくは持続性(発症後3~12カ月)の一次性免疫性血小板減少症の患者さんに対し、mezagitamabの3つの用量を週1回、8週間にわたり皮下投与し、プラセボと比較した臨床第2相試験です。同試験は現在も継続中ですが、中間解析においては、mezagitamabで検討したすべての用量において血小板反応が認められた人数の割合はプラセボよりも高い結果となりました。血小板数の増加は用量依存的であり、検討した最高用量で最大の血小板反応が認められました。mezagitamabの投与を受けた患者さんは、mezagitamab投与後、速やかに血小板反応が認められ、投与期間終了後も持続しました。また、安全性および忍容性は、3つの用量すべてにおいて概ね良好でした。
mezagitamabで検討したすべての用量において血小板反応が認められた人数の割合はプラセボよりも高い結果となりました。血小板数の増加は用量依存的であり、検討した最高用量で最大の血小板反応が認められました。mezagitamabの投与を受けた患者さんは、mezagitamab投与後、速やかに血小板反応が認められ、投与期間終了後も持続しました。
武田薬品工業株式会社は、これらの良好な結果を踏まえ、世界各地の医薬品規制当局と協議した後に、一次性免疫性血小板減少症を対象としたmezagitamabの国際共同臨床第3相試験を2024年度に開始する予定です。
武田薬品工業株式会社の消化器系・炎症性領域ユニットヘッドのChinwe Ukomadu氏は「今回得られた臨床第2相試験の結果は、mezagitamabが疾患を修飾する作用機序を有し、ITP患者さんに寛解をもたらす可能性を示しています。ITPの患者さんによっては、従来の治療薬が無効であったり、十分な効果が得られなかったりなど、大きなアンメットニーズが残っています。また、従来の治療薬で効果が得られても、副作用に苦しんだり、治療中に症状が再燃したりする患者さんもいます。今後、臨床第3相試験を開始し、臨床第2相試験のデータは医学学会で発表する予定です」と述べています。