皮膚バリア機能に重要な結合型セラミドの構造を解明、アトピー性⽪膚炎や⿂鱗癬などの治療薬の開発に期待
北海道大学は11月7日、これまで不明であった結合型セラミドの構造(システイン結合型P-EOセラミド)を解明し、その産⽣の反応様式を明らかにしたと発表しました。
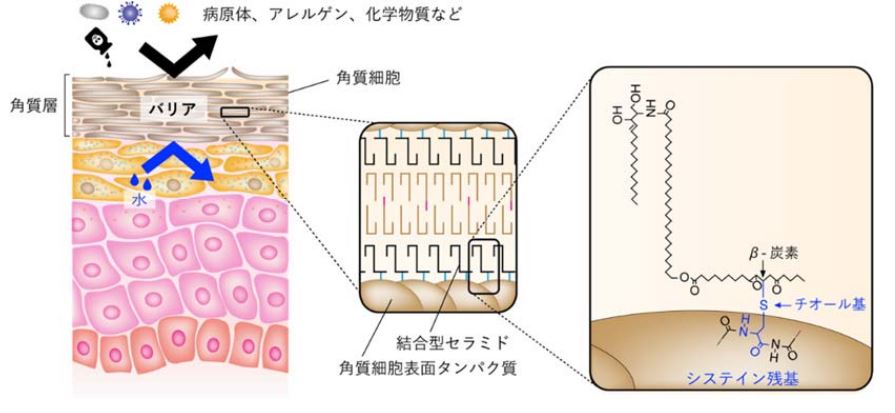
⽪膚の最も外側を構成する⾓質層は、病原体、アレルゲン、化学物質などの外界からの異物の侵⼊や、乾燥による⽔分喪失のリスクから守る透過性バリア(⽪膚バリア)として機能します。⾓質層を構成する⾓質細胞の表⾯には、タンパク質と結合した結合型セラミドと呼ばれる特殊なセラミドが存在し、皮膚バリア機能に重要な役割を果たしますが、正確な構造や結合するアミノ酸残基、反応様式についてはこれまで解明されていませんでした。
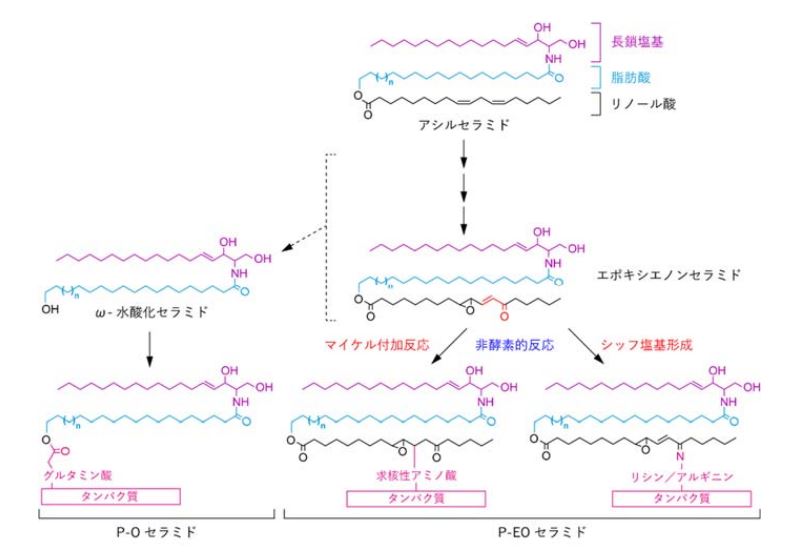
今回、研究グループは、結合型セラミド産生における中間体のエポキシエノンセラミド(EEセラミド)とエポキシエノン構造を模した化合物のEEアナログを用いたアミノ酸・ペプチドとの結合実験およびびマウスの表⽪を⽤いた解析を行いました。
画像はリリースより
その結果、結合型セラミドの構造がシステイン結合型P-EOセラミドであることを明らかにしました。
また、その構造を解明するために質量分析解析、核磁気共鳴分光解析を行ったところ、EEセラミドのエノン構造部位のβ-炭素がシステイン残基のチオール基と結合したものであることが分かりました。この結果は、EEアナログがシステインとマイケル付加反応によって結合したことを意味します。
画像はリリースより
また、システイン結合型P-EOセラミドがマウス表⽪中に実際に存在するかを調べところ、システイン結合型P-EOセラミドが実際に検出されました。⼀⽅、システイン以外のアミノ酸と結合したP-EOセラミドや、従来提唱されていたP-Oセラミドは検出できませんでした。

画像はリリースより
さらに、酸化剤及び還元剤を⽤いた実験を行い、溶出されたEEセラミドがシステイン結合型P-EOセラミドに由来することを明らかにしました。この結果に基づいて、結合型セラミドを可逆的、⾮可逆的画分に分け、マウス表⽪中のシステイン結合型P-EOセラミド量を定量することで、システイン結合型P-EOセラミドが結合型セラミドの少なくとも60%を占めることを明らかにしました 。
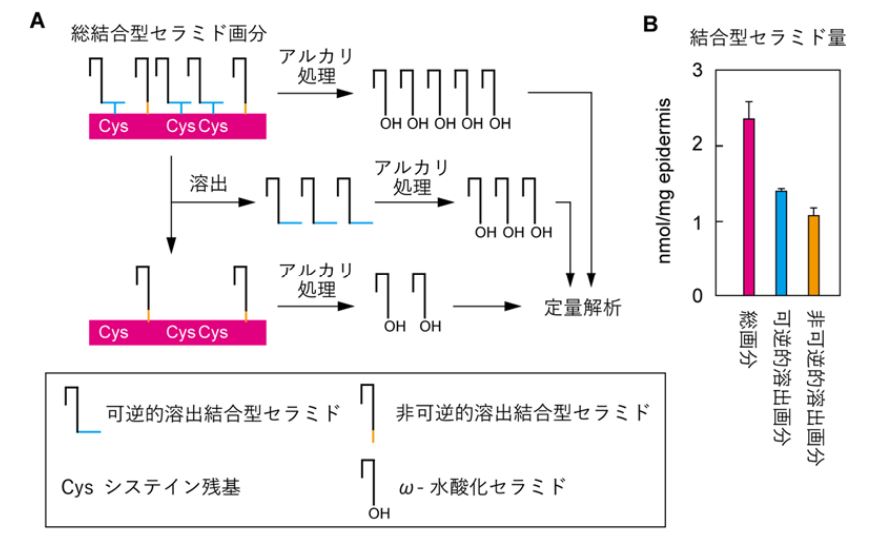
画像はリリースより
以上の結果から、表⽪に存在する主要な結合型セラミドが、⾓質細胞表⾯タンパク質のシステイン残基と、EEセラミドがマイケル付加反応により結合したシステイン結合型P-EOセラミドの2つであることが明らかになりました。
以上の研究成果より、これまで不明だった皮膚バリア形成の分子機構のと、⽪膚バリア異常を起因とするアトピー性⽪膚炎や⿂鱗癬などの治療薬の開発につながることが期待できるといいます。
なお、同研究の成果は、iScience誌オンライン版に、10月18日付で掲載されました。