あみろいどじんアミロイド腎Amyloid nephropathy
小児慢性疾患分類
- 疾患群2
- 慢性腎疾患
- 大分類5
- アミロイド腎
- 細分類25
- アミロイド腎
病気・治療解説
概念
アミロイドーシスは可溶性蛋白が凝集し,β構造を有する不溶化蛋白がさまざまな臓器に沈着することを介して臓器障害を引き起こす疾患であり,このうちアミロイド蛋白が腎糸球体に沈着し,組織障害を起こすものがアミロイド腎症である。
病因・病態
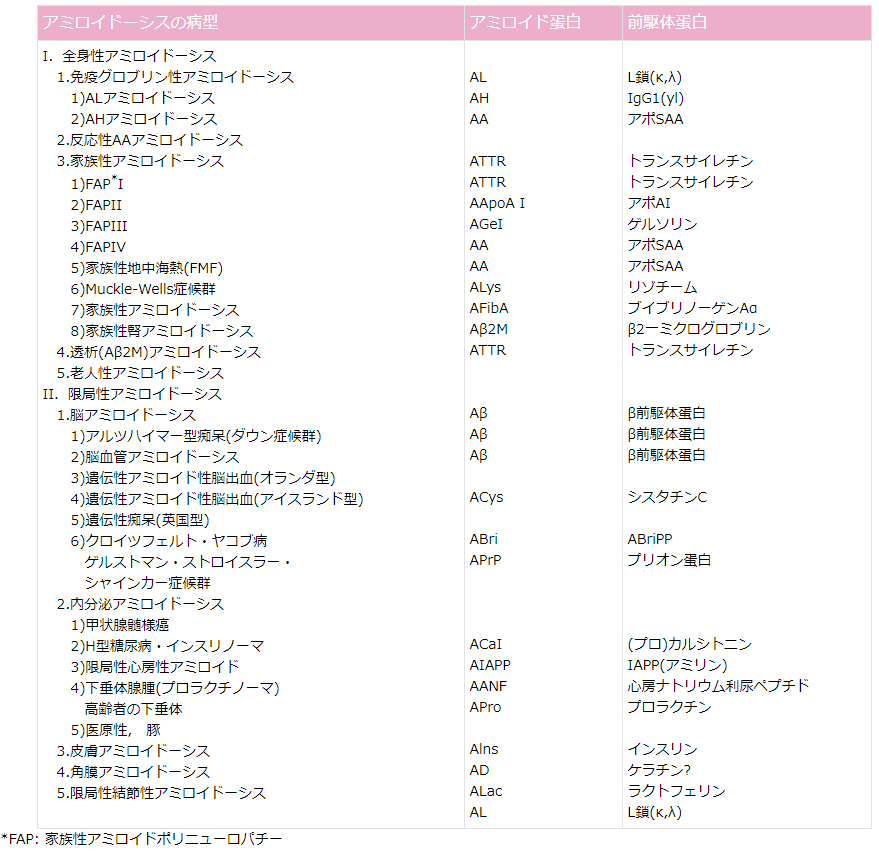
アミロイドーシスは, 1975年に発足した旧厚生省特定疾患「アミロイドーシス調査研究班」による旧分類では,原発性アミロイドーシス, 多発性骨髄腫に合併するアミロイドーシス,続発性アミロイドーシス,分類困難なアミロイドーシス,遺伝性アミロイドーシス,限局性アミロイドーシスに分類されていたが,最近ではアミロイドの前駆蛋白の種類をもとに分類されている(表)(1-3)。
アミロイド蛋白の種類によって沈着部位に違いが認められ,さまざまな病型を呈する。免疫グロブリン軽鎖light chain由来のALアミロイド, 主として肝細胞で産生される急性期蛋白〔serum amyloid A (SAA)〕由来のAAアミロイドは腎に沈着しやすいことが知られている。 わが国でアミロイド腎症を生じる頻度が高いものは,多発性骨髄腫に伴ったもしくは原発性のALアミロイドーシスや,慢性炎症に伴った反応性AAアミロイドーシスである。また,頻度は少ないが家族性地中海熱でもAAアミロイドが蓄積することが知られている。
腎では多くの症例で糸球体のメサンギウムや係蹄内にアミロイド沈着を認めることがある。また,間質の特に血管壁に蓄積を認めることも多い。電顕で観察すると,幅10nm前後の細線維構造が認められる。
透析歴が10年を超える長期透析患者では,手根管,脊柱近傍,肩,股関節など比較的動きが大きい部位を中心としてアミロイドが蓄積し,周囲の関節破壊などを引き起こすなどさまざまな症状を呈することがよく知られ (透析アミロイドーシス),その原因蛋白はβ2-MGであることが明らかにされている(4, 5)。β2-MGは透析患者血漿中には正常人に比べてきわめて高濃度に存在し,そのことが透析アミロイドーシス発症の主たる要因であると考えられている。アミロイド自体の蓄積は透析開始後比較的早期から認められるにも関わらず,発症までには長期間かかることから,蓄積したアミロイドがなんらかの変化を受けることにより炎症を惹起するのではないかと考えられている (6)。
臨床症状
蛋白尿,糸球体濾過率の低下(腎機能障害)が認められる場合が多い。従って,診断には持続性蛋白尿や腎機能障害などの臨床症状および腎生検によるアミロイドの沈着を証明することが必要である(6)。
診断
アミロイドーシスの診断をする上で最も大切なことは,患者の症候からアミロイドーシスを疑うことである。アミロイドが沈着した臓器の機能が障害されるため,全身性アミロイドーシスでは全身諸臓器の,限局性アミロイドーシスでは特定の臓器や組織の症候がみられる。
腎アミロイドーシスの確定診断は腎生検にて病理学的にアミロイドを証明することである。アミロイドの証明はコンゴレッド染色で濃紅色に染色され,偏光顕微鏡で複屈折性を示すことによってなされる。この特徴はすべてのアミロイドに共通である。アミロイドが証明されれば,次にその蓄積している蛋白の種類を同定することになる。組織片を過マンガン酸カリウムで前処理しておくと,AAアミロイドーシスの場合にはコンゴレッドに対する親和性を失い,コンゴレッドで染色されないが,ALアミロイドーシスは染色性が保たれるという性質が両者の鑑別に用いられている。しかし,過マンガン酸カリウム法は,ALアミロイドーシスをAAアミロイドーシスと誤診することがあり特異性が必ずしも高くないことが知られている。最近では,抗L鎖抗体,抗AA抗体,抗トランスサイレチン抗体,抗β2-MG抗体などの特異的抗体を用いることによって,免疫組織学的に蓄積している蛋白を同定し,アミロイドーシスのタイプを同定することが行われるようになっている。ただし,適切な抗体濃度の調整や賦活処理が必要となる。さらにALアミロイドは通常市販されている抗L鎖抗体では染色性が弱いこともある。λ鎖や,κ鎖の定常域の一部のアミノ酸配列に相当する合成ペプチドに対する抗血清や可変域に対する抗体などを用いることによりALアミロイドーシスの診断を行うこともある(7, 8)。
治療・予後
アミロイドーシスの根本的治療としては,原因となるアミロイド蛋白を減少させるか,蓄積しているアミロイド蛋白を除去することが考えられるが,臨床的には原因となるアミロイド蛋白を減少させようという試みが主として行われている。
ALアミロイドーシスは形質細胞異常症を背景とした原発性のものが多く,無治療では診断からの平均余命が約1年,心機能障害が発症すると約6か月とされ,きわめて予後不良である。多発性骨髄腫に伴うALアミロイドーシスでは多発性骨髄腫の治療が行われる。原発性アミロイドーシスにおいても多発性骨髄腫の治療に準じた治療が行われることが多い。
経ロメルファラン+プレドニゾロン療法(MP療法)が従来行われてきたが,MP療法による完全寛解は稀であり,有効な治療がないと考え対症療法のみを行うことも多かった。近年,自家末梢血幹細胞移植を併用した大量メルファラン療法や,メルファラン+デキサメタゾン療法などにより比較的良好な経過が認められるようになり,特に自家末梢血幹細胞移植を併用した大量メルファラン療法では血液学的に寛解する症例も認められるようになってきており,症例を選べば有効な治療もできるようになっている (9, 10)。
AAアミロイドーシスは慢性炎症性疾患に二次的に発症することが多い。急性期蛋白のSAAが前駆蛋白となる。予後はALアミロイドーシスほど不良ではないが,診断確定からの5年生存率は50~60%といわれ必ずしも良好ではない。AAアミロイドーシスの治療の基本は,炎症の原因となる疾患の治療を十分に行うことである。関節リウマチが原疾患であることが多く,その場合,副腎皮質ステロイドや免疫抑制薬などを用いてCRPが低下した群の方が腎機能の進展が緩やかである。このことは厚生労働省研究班の調査でも判明しており,原病の治療の重要性が示されている。
近年,TNF-α阻害薬がわが国でも関節リウマチの治療に対して承認され,関節リウマチの治療方法に変化がみられている。TNF-α阻害薬で関節リウマチを治療するとAAアミロイドーシスの腎症が改善する場合があることが示されている(11)。
表 アミロイドーシスの分類
参考文献
1) 山田正仁,他.厚生労働科学研究費補助金 難治性疾患克服研究事業「アミロイドーシスに関する調査研究班」. アミロイドーシス診療ガイドライン2010, 2010
2) Dember LM. Amyloidosis-associated kidney disease. J Am Soc Nephro117:3458-3471, 2006
3) 石原得博.アミロイドーシスの分類腎と透析62:149-153, 2007
4) 下条文武: 透析アミロイドーシスー発症機序解明と治療戦略. 日本内科学会雑誌94:56-60, 2005
5) Gejyo F, Yamada T, Odani S, et al. A new form of amyloid protein associated with chronic hemodialysis was identified as β2-microglobulin. Biochem Biophys Res Commun129:701-706, 1985
6) Miyata T, Jadoul M, Kurokawa K, et al. β2 microglobulinin renal disease.J am Soc Nephrol 9 :1723-1735, 1998
7) 乳原善文, 香取秀幸, 曽川陽子, 他:腎アミロイドーシスの診断と治療. 腎と透析62: 231-241, 2007
8) Hoshii Y, Setoguchi M, Iwata T, et al. Useful polyclonal antibodies against synthetic peptides corresponding to immunoglobulin light chain constant region for immunohistochemical detection of immunoglobulin light chain amyloidosis. Pathol Int 51:264-270, 2001
9) Hoshii Y, Kiyama M, Cui D, Kawano H, Ishihara T. Immunohistochemical study of immunoglobulin light chain amyloidosis with antibodies to the immunoglobulin light chain variable region. Pathol Int 56:324-330, 2006
10) Jaccard A, Moreau P, Leblond V,et al. High-dose melphalan versus melphalan plus dexamethasone for AL amyloidosis. N Engl J Med 357:1083-1093, 2007
11) Cibeira MT, Sanchorawala V, Seldin DC, et al. Outcome of AL amyloidosis after high-dose melphalan and autologous stem cell transplantation: long-term results in a series of 421 patients. Blood 118:4346-4352, 2011
12) Gottenberg JE, Merle-Vincent F, Bentaberry F, et al. Anti-tumor necrosis factor alpha therapy in fifteen patients with AA amyloidosis secondary to inflammatory arthritides: a followup report of tolerability and efficacy. Arthritis Rheum 48:2019-2024, 2003
小児慢性特定疾患情報センターhttps://www.shouman.jp/より、許可をいただき掲載しております。
この疾患に関するピックアップ記事、イベントはありません