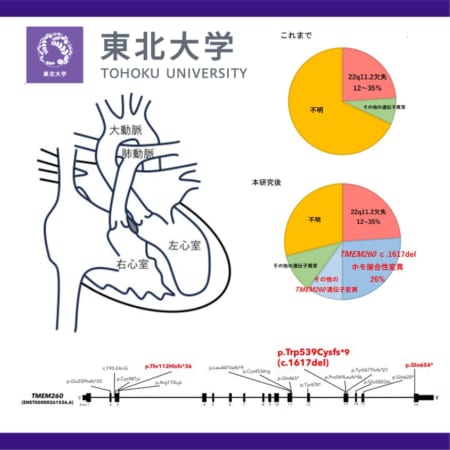
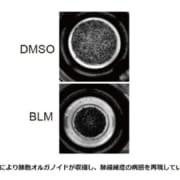
【米国】クローン病治療薬リサンキズマブがウステキヌマブとの直接比較試験にてすべての主要評価項目および副次評価項目を達成
米アッヴィ社は10月10日、1種類以上の抗TNF-α抗体製剤による治療が不成功であった中等症から重症の活動性クローン病患者さんを対象に、リサンキズマブ(販売名:スキリージ)とウステキヌマブ(販売名:ステラーラ)を直接比較した第III相SEQUENCE試験のトップライン結果を発表しました。
リサンキズマブは、インターロイキン-23(IL-23)の p19 サブユニットに結合することにより IL-23 を選択的にブロックする IL-23 阻害薬です。炎症プロセスに関与するサイトカインである IL-23 は、多くの慢性免疫関連疾患に関連すると考えられています。リサンキズマブは、これまでに尋常性乾癬、関節症性乾癬(乾癬性関節炎)およびクローン病の治療薬として、米国食品医薬品局(FDA)および欧州医薬品庁より承認されました。
SEQUENCE試験の第1の主要評価項目である24週時の臨床的寛解の結果は、リサンキズマブ群の寛解率59%に対し、ウステキヌマブ群の寛解率は40%であり、リサンキズマブのウステキヌマブに対する非劣性が示されました。
さらに、第2の主要評価項目である48週時の内視鏡的寛解の結果では、リサンキズマブ群の寛解率32%に対し、ウステキヌマブ群の寛解率は16%であり、リサンキズマブのウステキヌマブに対する優越性が示されました。
一方の安全性として、SEQUENCE 試験におけるリサンキズマブの安全性プロファイルは、これまでに確認されているリサンキズマブの安全性プロファイルと一致しており、新たな安全性のリスクは認められませんでした。
フランスのインフィニティ研究所代表であり、ナンシー大学病院消化器内科教授兼炎症性腸疾患グループ長である Laurent Peyrin-Biroulet氏は「SEQUENCE試験のような直接比較試験は、臨床診療の場で医師がそれぞれの治療法の違いを理解し、治療アルゴリズムを決定する際の参考となる重要なものです。今回の結果によって、これまでに蓄積されたリサンキズマブのクローン病に対するエビデンスに、さらに新たなエビデンスが加わりました。今回の試験は、対象患者さんの臨床的・内視鏡的治療目標の達成促進における、ウステキヌマブと比較した場合のリサンキズマブの効果を示しただけでなく、これまでの試験で確認された安全性プロファイルを裏付ける結果となっています」と述べています。
SEQUENCE試験の詳細な結果は、今後、学会での公表や査読誌への投稿を行う予定です。