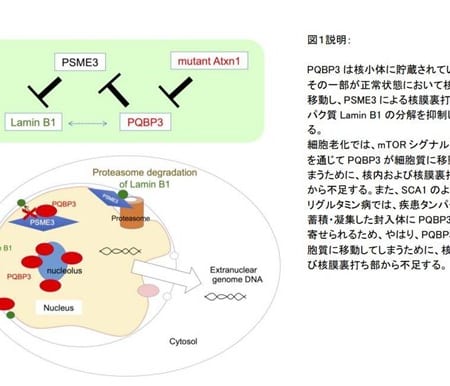
抗CD19モノクローナル抗体製剤ユプリズナ、全身型重症筋無力症への適応追加を申請
田辺三菱製薬株式会社は10月14日、「ユプリズナ点滴静注100㎎(一般名:イネビリズマブ(遺伝子組換え))」について、全身型重症筋無力症(gMG)の適応追加申請を10月14日付で厚生労働省へ行ったと発表しました。
重症筋無力症(指定難病11)は、末梢神経と筋肉の接つなぎ目(神経筋接合部)において、病原性自己抗体が関与する慢性の自己免疫疾患です。このうち、全身型重症筋無力症は、眼周囲、眼球、四肢、呼吸器などに影響を及ぼす全身型の筋力低下を特徴とします。重症度は、日常生活に支障をきたす場合から、生命を脅かす呼吸不全までさまざまです。
国内の重症筋無力症患者数は、2018年の全国疫学調査によると約29,000人と推定されており、そのうちの約80%が全身型重症筋無力症患者さんであると報告されています。全身型重症筋無力症の治療薬として、ステロイドやステロイド以外の免疫抑制剤、分子標的薬などが承認されていますが、病原性自己抗体を産生するB細胞を直接の標的とした治療薬は現在ありません。
ユプリズナは、自己抗体産生CD19陽性B細胞を標的として、持続的に枯渇させるヒト化モノクローナル抗体(mAb)です。患者さんは、初回投与の14日後に2回目の投与を受け、以降は初回投与から6ヵ月ごとに1回の投与を受けることになります。全身型重症筋無力症に対する希少疾病用医薬品の指定を厚生労働省より受けています。
今回の申請は、ユプリズナの導入元である米アムジェン社と共同で実施した、全身型重症筋無力症の患者さんを対象とした第3相国際共同治験(MINT試験)のデータに基づいて実施されています。
田辺三菱製薬はプレスリリースにて、「希少疾患を含めたアンメット・メディカル・ニーズに応える医薬品を自社開発や他社等とのパートナリングを通して患者さんへ提供できるよう取り組んでいきます」と述べています。