ムコ多糖症IIIB型を対象としたJR-446の臨床第I/II相試験で初回投与を開始
株式会社メディパルホールディングスと、JCRファーマ株式会は12月3日、JCRが創製した血液脳関門通過型α-N-アセチルグルコサミニダーゼ製剤(開発番号:JR-446)について、ムコ多糖症IIIB型(サンフィリッポ症候群B型)を対象とした日本国内での臨床第I/II相試験において、第1例目となる被験者への初回投与が行われたと発表しました。
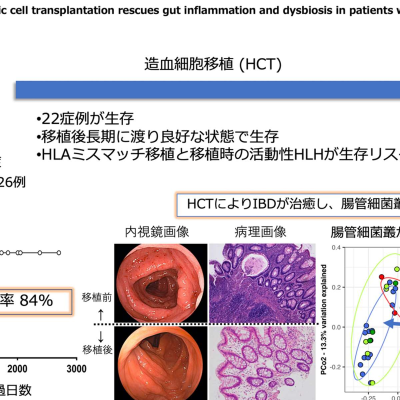
ムコ多糖症IIIB型(サンフィリッポ症候群B型)は、ライソゾーム病(指定難病19)の一種であり、欠損している酵素の種類によりA型~D型に分類される、重度の中枢神経障害を呈する疾患です。世界におけるムコ多糖症IIIB型の患者数は、は500人から1,000人と推定され、これまでに承認されている治療法はありません。JCRは非臨床試験において、独自の血液脳関門通過技術「J-Brain Cargo」を使用したJR446がムコ多糖症IIIB型(サンフィリッポ症候群B型)に関連する症状に対する効果を示すことを確認しています。
今回の臨床試験は、18歳未満のムコ多糖症IIIB型(サンフィリッポ症候群B型)の患者さんを対象とした多施設共同の単群非盲検試験です。JR-446の安全性、忍容性、並びに潜在的有効性の評価を主な目的としており、複数用量のJR-446を投与することで、至適用量も評価します。
メディパルとJCRはプレスリリースにて、「2023年9月に、JR-446のMPSIIIBを対象疾患とした海外事業化に関する実施許諾契約および日本における共同開発・商業化契約を締結しています。今後も、両社は、協業による超希少疾病用医薬品の開発を行うことで、治療薬を待ち望んでいる患者さんに貢献できる取り組みを推進し、だれもが心身ともに健やかに暮らせる社会の実現と企業価値の向上を目指していきます」と述べています。