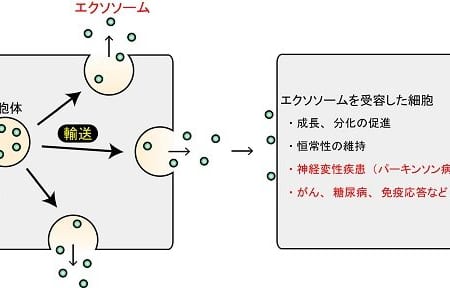
ヒトiPS細胞由来腎オルガノイドを用いてアルポート症候群の病態の疾患モデルを開発、新規治療法の可能性を示唆
京都大学iPS細胞研究所(CiRA)は9月28日、ヒトiPS細胞由来腎オルガノイド (腎臓様の構造体) を用いてアルポート症候群の病態モデルを開発し、創薬候補物質の選択に有用であることを確認したと発表しました。
アルポート症候群は、糸球体基底膜を構成するIV型コラーゲンの遺伝子変異が原因で発症する遺伝性腎疾患です。遺伝子変異により、血液のろ過に重要な糸球体基底膜が脆弱するほか、難聴や視力障害を伴います。小児期に発症し、20代~30代と比較的早期に末期腎不全に進行するため、患者さんの生活に大きな支障をきたします。現在、アルポート症候群の有効的な治療法は少なく、新規治療法の開発が望まれています。一方で、糸球体基底膜の異常などアルポート症候群の病態を細胞レベルで再現することは難しく、有効な新規治療法開発に向けた課題となっています。
今回、研究グループは、軽症型および重症型アルポート症候群の患者さん由来のiPS細胞と軽症型のiPS細胞において原因遺伝子を正常型に修復したiPS細胞を作製し、患者さん由来のiPS細胞をもとに、腎オルガノイドの作製方法を改良することで、アルポート症候群の病態を再現可能か検証しました。
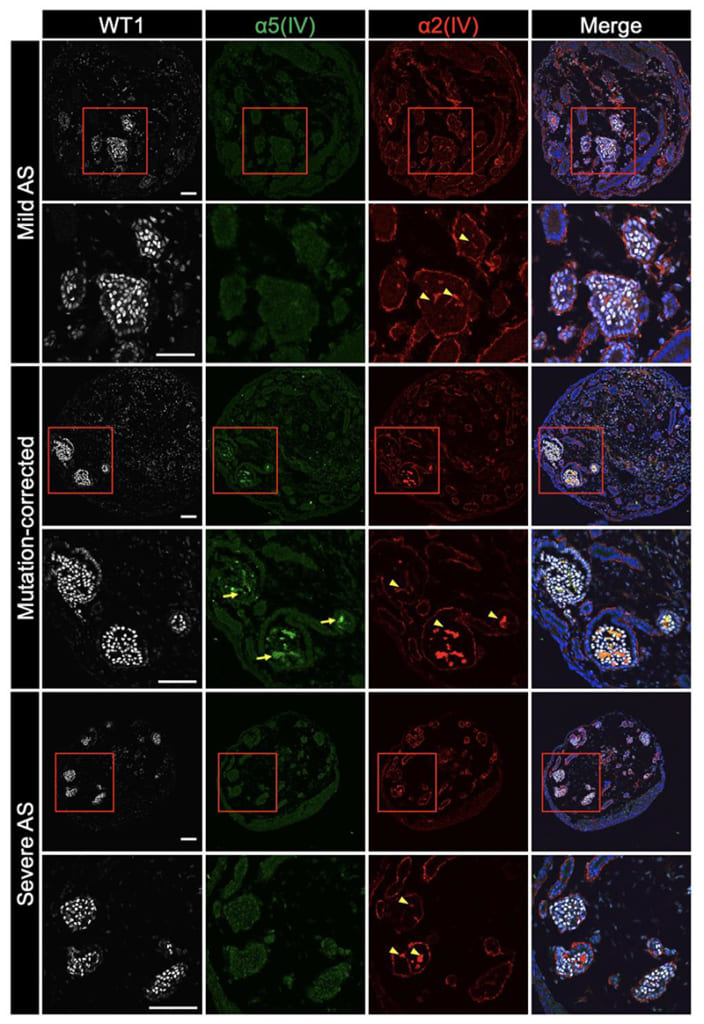
その結果、これらのiPS細胞から作製した腎オルガノイドはアルポート症候群様の病態を示しました。
画像はリリースより
また、アルポート症候群患者さん由来iPS細胞から作製された腎オルガノイドは軽症型および重症型の特徴をそれぞれ反映しました。このことから、腎オルガノイドを用いてアルポート症候群患者さんの個人間の病態の差異を再現することができたと考えられます。
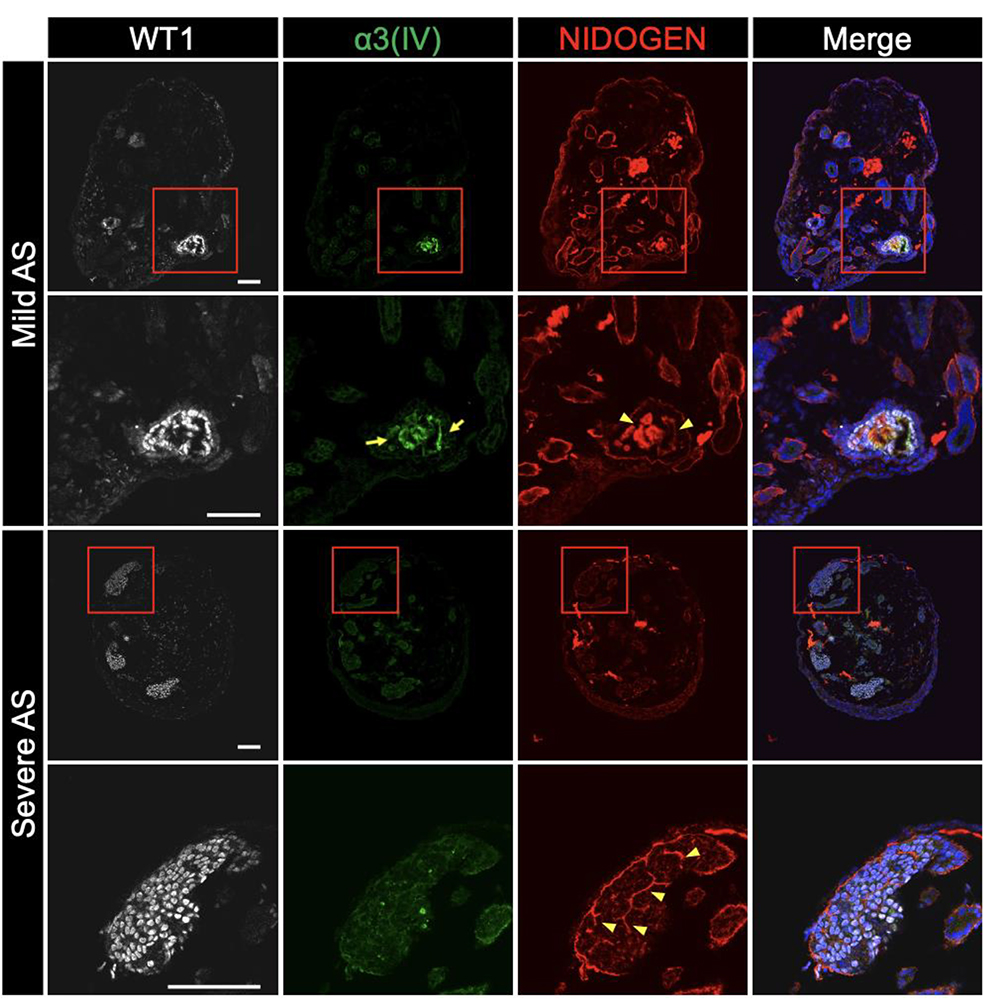
画像はリリースより
さらに、軽症型iPS細胞から作製した腎オルガノイドに、タンパク質の構造異常を修正するとされる化合物4-PBA、TMAO、mannitolを添加したところ、低分子化合物を用いてタンパク質の構造異常を修復する「ケミカルシャペロン療法」が新たな治療法となりうることが示唆されました。
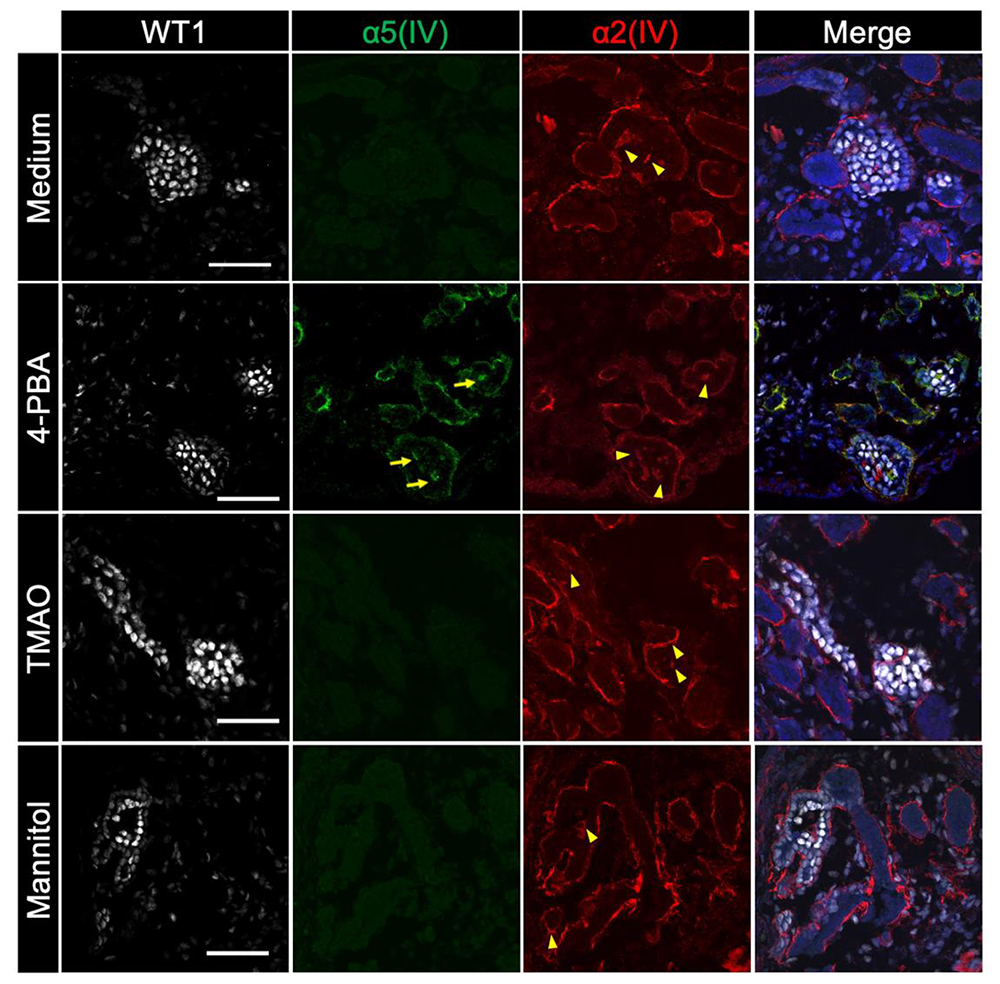
画像はリリースより
以上の研究成果より、研究グループは、アルポート症候群の患者さんから樹立したヒトiPS細胞由来の腎オルガノイドが、アルポート症候群の病態を再現する培養系の疾患モデルとなることを立証しました。さらに、今回開発した疾患モデルを使用して、タンパク質の構造異常を修復する「ケミカルシャペロン療法」が有効である可能性を示しました。研究グループは、アルポート症候群の新規治療法の開発や病態の解明、非侵襲的な診断方法の開発が進み、患者さんが安心して受けることのできる新たな医療の実現につながることが期待できるといいます。
なお、同研究の成果は、英科学誌「Communications Biology」に、9月28日付で掲載されました。