重篤な希少遺伝疾患NGLY1欠損症の発症機構の解明
東京都医学総合研究所は7月5日、重篤な希少遺伝疾患であるNGLY1欠損症の発症メカニズムを解明したと発表しました。
この成果は、同研究所ユビキチンプロジェクトの吉⽥雪⼦主席研究員・松⽥憲之プロジェクトリーダー、⽥中啓⼆理事⻑、理化学研究所、タケダ-CiRA 共同研究プログラム(T-CiRA)、日本医療研究開発機構からなる共同研究チームによるもので、米国科学誌「PNAS」オンライン版に掲載されました。
細胞質ペプチド:N−グリカナーゼ(NGLY1)欠損症は、発育の不全、四肢の筋力低下、不随意運動、てんかん、脳波異常、無涙症、新生児の肝機能障害などを引き起こす重篤な疾患です。NGLY1は、細胞質内でタンパク質のN型糖鎖を根元から切断する酵素で、身体の中で間違って合成され、構造が異常になったタンパク質のクリアランスに関わります。
理化学研究所とT-CiRA(京都大学iPS細胞研究所(CiRA)と、武田薬品工業の共同研究プログラム)は、NGLY1欠損症の治療法の開発を目指し、患者さんの症状と類似した表現型を示す動物モデルをこれまでに開発してきました。その中で、B6というマウス系統では、NGLY1遺伝子を欠損すると胚性致死することが報告されていました。
今回、同研究グループは、NGLY1遺伝子欠損B6マウスにおいて、糖鎖認識ユビキチン付加酵素のひとつである「FBS2」の遺伝子も同時に欠損させることで、胚性致死を回復させ、ほぼ正常に生育することを発見。NGLY1のない状態では、FBS2が生体に異常を引き起こす可能性があると考察しました。
次に、NGLY1遺伝子を破壊した培養細胞にFBS2を発現させたところ、細胞が増殖せず、細胞死を起こすことを確認。NGLY1がない細胞でFBS2が働くと、分解シグナルであるユビキチン鎖が異常についた糖タンパク質が細胞に溜まり、プロテアソームの機能が落ちてしまうことが判明しました。
プロテアソームは、細胞の増殖などに欠かせない分解装置で、うまく働かないと細胞は死んでしまいます。細胞にはプロテアソームの活性を維持する機構があり、プロテアソームは活性が低下すると、転写因子の「NRF1」によって新たなプロテアソームが作られるようになります。しかし、FBS2がNRF1を異常にユビキチン化することで、プロテアソームの活性回復機能を損なうことも明らかになったとしています。
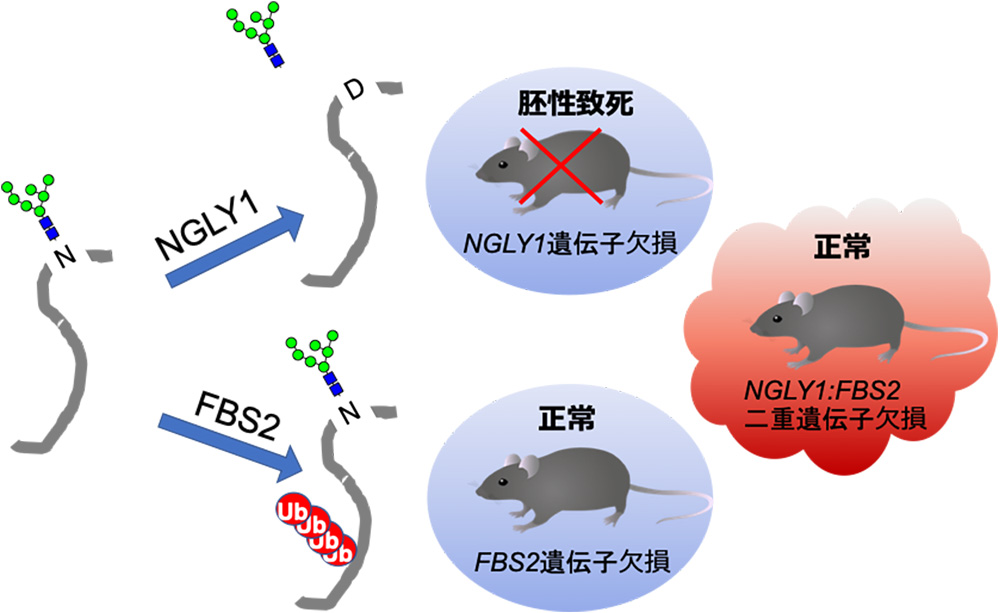
胚性致死のNGLY1遺伝子欠損マウスの組織中では、NRF1のユビキチン化が認められた一方、NGLY1/FBS2の二重遺伝子欠損マウスではユビキチン化がみられないことから、生体内でも同様にプロテアソーム活性の低下が致死性を引き起こしている可能性が考えられるそうです。
今回の成果について、研究グループはプレスリリースにて、「FBS2遺伝⼦⽋損マウスは異常な表現型がなく、NGLY1がない場合にFBS2が働くことが⽣体に悪影響を及ぼすと考えられることから、FBS2の活性を特異的に抑制することは、NGLY1⽋損症の治療につながる可能性があります。そのため、本研究で得られたマウスの知⾒がヒトにおいても同様であるかを、今後研究を進めていく予定です」と述べています。