筋萎縮性側索硬化症(ALS)における異常なTDP-43凝集体形成メカニズムを解明
新潟大学は6月29日、家族性筋萎縮性側索硬化症(ALS)由来のオプチニューリン変異体がTIA1蛋白質の発現を増加させ、このTIA1がユビキチン化されたTDP-43蛋白質(Ub-TDP-43)の分解を抑制し、Ub-TDP-43蛋白質の病的な凝集体を形成させることを明らかにしたと発表しました。
この研究成果は、同大大学院医歯学総合研究科ウイルス学分野の垣花太一助教、藤井雅寛教授らの研究グループによるもので、科学誌「iScience誌」のオンライン速報版に6月17日付で掲載されました。
ALSの運動神経細胞では、ユビキチン化されたTDP-43蛋白質(Ub-TDP-43)の凝集体が形成され、この凝集体が神経細胞に毒性を示し、ALSを発症させます。TDP-43、オプチニューリン、TIA1は、家族性ALSと孤発性ALSの原因遺伝子であり、オプチニューリンとTIA1に変異のあるALS患者さんの脳病変部位でも、Ub-TDP-43の凝集体が確認されていることから、これら3つのALS原因遺伝子が同じ分子メカニズムでALSを発症させていると考えられています。しかし、Ub-TDP-43の凝集体形成の仕組みやオプチニューリンとTIA1がTDP-43凝集体の形成をどのように誘導しているのかは不明でした。
今回、研究グループはUb-TDP-43蛋白質凝集体の形成をオプチニューリンとTIA1が制御していることを発見。家族性ALS由来のオプチニューリン変異体を発現させた細胞を熱ストレスにさらしたところ、TIA1蛋白質の発現量が増加し、このTIA1がUb-TDP-43蛋白質の分解を阻害し、Ub-TDP-43凝集体の形成を誘導したといいます。一方、正常なオプチニューリンの発現量が減少した細胞でもTIA1の発現量が増加。Ub-TDP-43蛋白質の分解が阻害され、Ub-TDP-43蛋白質の凝集体が形成されたそうです。これらの結果から、正常なオプチニューリンとは対照的に、ALS関連のオプチニューリン変異体ではTIA1の発現が抑制されず、Ub-TDP-43蛋白質の量が増加し、Ub-TDP-43の凝集体が誘導されることが判明しました。
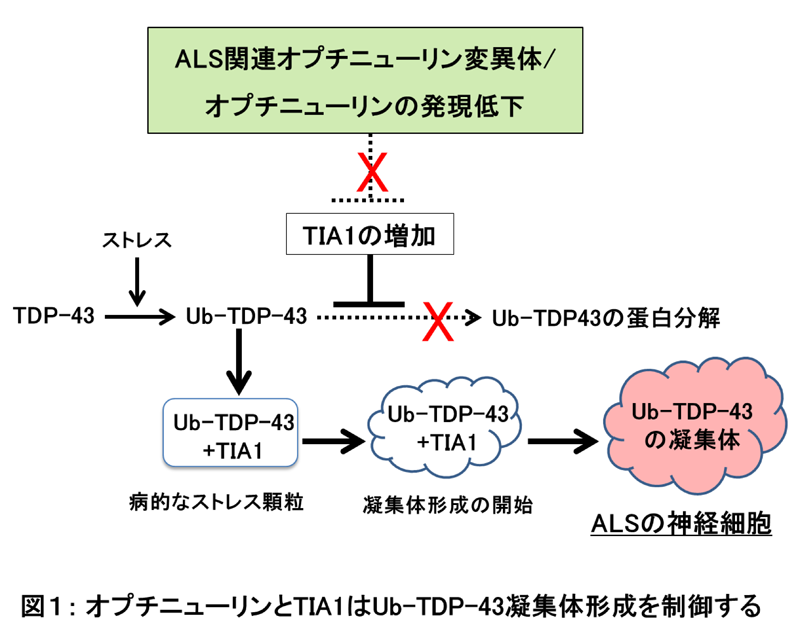
また、家族性ALSのオプチニューリン変異体を発現させた細胞では、Ub-TDP-43がTIA1とともにストレス顆粒(さまざまなストレスによって細胞質内に誘導される蛋白質の集合体)に局在していました。ストレス顆粒に局在したTDP-43が病的なTDP-43凝集体を形成することがこれまでの研究で示唆されており、今回の結果は、TIA1がUb-TDP-43をストレス顆粒に局在させ、Ub-TDP-43の分解を阻害していることを示唆しているといいます。
ALSにおいてUb-TDP-43の凝集体がどのように形成されるのかはこれまで不明でしたが、今回の研究成果によって、家族性ALS由来のオプチニューリン変異体は、Ub-TDP-43凝集体の形成を促進すること、TIA1の発現増加が病的なUb-TDP-43蛋白質凝集体の形成を促進することも判明しました。これらの結果は、オプチニューリンとTIA1がALSの治療標的として有望であることを示しているといいます。
研究グループはプレスリリースにて、「今後は、TDP-43、オプチニューリン、TIA1の変異を持たないALS患者において、オプチニューリンとTIA1がUb-TDP-43凝集体の形成にどのように関与しているかを解析する予定です。さらに、今回の研究により、オプチニューリンとTIA1がALS治療薬の有望なターゲット分子であることがわかりました。今後は、オプチニューリンとTIA1を標的としたALS治療薬の開発を進めていく予定です」と述べています。
出典元
新潟大学 プレスリリース











