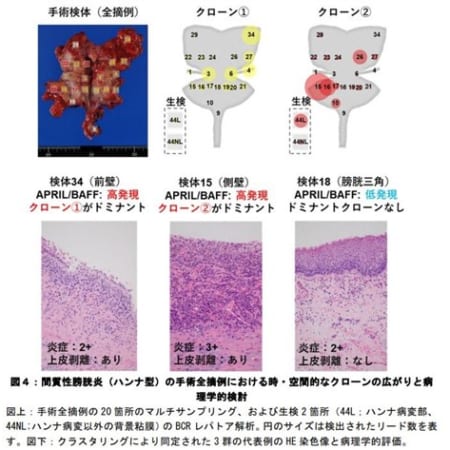
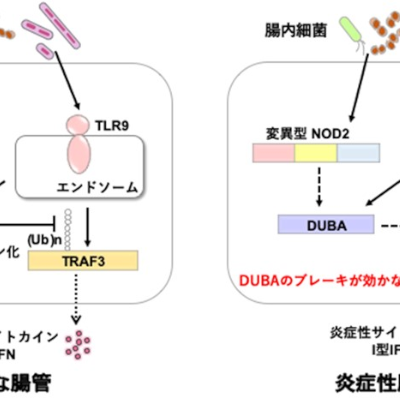
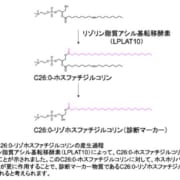
再発型多発性硬化症に対し新規B細胞療法の承認申請を受理
ノバルティスは2020年2月24日、米国食品医薬品局(FDA)と欧州医薬品庁(EMA)が、成人の再発型多発性硬化症(RMS)の治療薬として、オファツムマブ(OMB157)が生物製剤承認一部変更申請および販売承認申請を受け入れたことを発表しました。生物製剤承認一部変更申請(sBLA)とは、米国食品医薬品局に対し生物製剤の適応症を追加する場合の申請方法のことを指します。
オファツムマブは、月に1度の自己注射投与が必要なモノクローナル抗体です。特定の種類の免疫細胞にくっつくことで、炎症を起こしている細胞を減少させる効果があります。月に1度の投与では投与中断後に免疫細胞が速やかに開腹することも示されています。ノバルティスは2015年12月に、MSを含むすべての適応症についてオファツムマブに対する権利をジェンマブ社より取得しています。
ノバルティスのKrishnan Ramanathan氏は以下のようにコメントしています。
効果的な治療法を模索する患者さんや医師にとって、オファツムマブが心強い第一選択薬となる可能性があることを嬉しく思います。私たちは、オファツムマブによって、多発性硬化症患者さんのより充実した、すこやかな毎日のために、新しい発想で医療に貢献できるよう、絶え間ない取り組みを進めています。今後、多発性硬化症患者さんが一日も早くこの薬剤にアクセスできるよう、規制当局と緊密に連携していく予定です。
https://www.novartis.co.jp/news/media-releases/prkk20200306
オファツムマブが承認された場合、幅広い再発型多発性硬化症の患者さんを対象に第一選択薬となる可能が高く、ペン型オートインジェクターを利用した治療管理の容易な治療薬となる可能性があります。