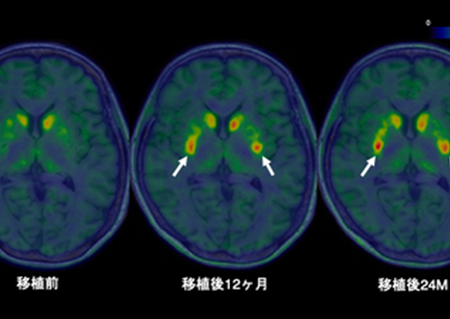
セルメチニブ、叢状神経線維腫を有する神経線維腫症1型小児患者に対する治療薬として欧州医薬品評価委員会が承認勧告
英アストラゼネカ社は現地時間4月27日、同社および米MSD社のセルメチニブについて、 手術不能かつ症候性の叢状神経線維腫(PN)を有する3歳以上の小児の神経線維腫症1型(NF1)を適応症とする治療薬として、 欧州連合(EU)において 条件付き製造販売承認が勧告されたと発表しました。
NF1は世界中で3,000人に1人が罹患している遺伝性疾患で、患者さんの30~50%には神経鞘に腫瘍(PN)が発現し、外見の変化、運動機能障害、疼痛、気道機能不全、視覚障害および腸や膀胱の機能不全などの病的状態を引き起すことがあります。
今回の肯定的見解は、米国国立がん研究所(NCI)の米国癌治療評価プログラム(CTEP)によるSPRINT試験第II相パート層1の結果に基づくもの。同試験における客観的奏効率(ORR)は、セルメチニブ単剤を1日2回経口投与されたPNを有するNF1小児患者さんで66%(50例中33例が確定部分奏効例)でした。承認勧告の条件として、SPRINT試験のより長期の追跡調査における安全性および有効性データを欧州医薬品評価委員会(CHMP)に提供する予定としています。
セルメチニブは2020年4月、手術不能かつ症候性のPNを有するNF1小児患者さんに対する治療薬として米国で承認されています。なお、同剤は日本国内においては未承認です。